Autor:
Lewis Jackson
Dátum Stvorenia:
5 Smieť 2021
Dátum Aktualizácie:
1 V Júli 2024

Obsah
Mol je štandardná jednotka merania v chémii, ktorá sa používa na sledovanie rôznych prvkov v zlúčenine. Zvyčajne sa zložená hmotnosť počíta v gramoch (g) a je potrebné ju prepočítať na molárne jednotky. Prechod je dosť jednoduchý, stále však zostáva niekoľko dôležitých krokov, ktoré musíme urobiť. Pomocou nižšie uvedenej metódy môžete ľahko prevádzať gramy na móly.
Kroky
Časť 1 z 2: Vypočítajte molekulovú hmotnosť
Pripravte si potrebné zásoby na vyriešenie matematického problému. Ak budete mať k dispozícii všetky nástroje, bude ľahšie problém vyriešiť. Potrebujete:
- Ceruzka a papier. Matematika sa uľahčí, keď si všetko zapíšete na papier. Musíte predložiť všetky kroky, aby ste dosiahli maximálne skóre.
- Periodická tabuľka chemických prvkov: používa sa na určenie hmotnostných atómov prvkov.
- Vrecková kalkulačka: slúži na výpočet zložitých čísel.

Určte, ktoré prvky sú v zlúčenine, ktoré chcete previesť na molárne jednotky. Prvým krokom pri výpočte molekulovej hmotnosti je určenie prvkov, ktoré tvoria zlúčeninu. Je to ľahké, pretože skratka pre prvky predstavuje iba jeden až dva znaky.- Ak je látka v skratke s dvoma znakmi, prvé písmeno je veľké a druhé písmeno malé. Príklad: Mg je skratka pre prvok horčík.
- Zlúčeniny NaHCO3 Skladá sa zo štyroch prvkov: sodík (Na), vodík (H), uhlík (C) a kyslík (O).
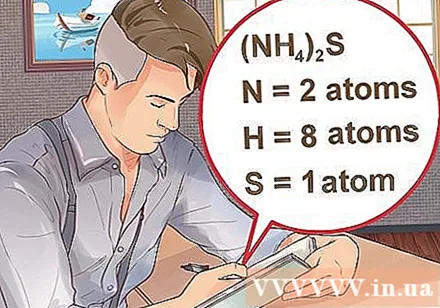
Určte počet atómov pre každý prvok v zlúčenine. Potrebujete poznať atómové číslo každej látky v zlúčenine, aby ste mohli vypočítať hmotnostnú molekulu tejto zlúčeniny. Malé číslo vedľa skratky prvku predstavuje atómové číslo prvku.- Príklad: zlúčenina H2O má dva atómy vodíka a jeden atóm kyslíka.
- Ak je zlúčenina napísaná v zátvorkách, za ktorými nasleduje malý index, znamená to, že každá zložka v zátvorkách tento index vynásobí. Príklad: zlúčenina (NH4)2S sa skladá z dvoch atómov N, ôsmich atómov H a jedného atómu S.

Zapíšte si kubický atómový papier pre každý prvok. Použitie periodickej tabuľky je najjednoduchší spôsob, ako nájsť kubický atóm prvku. Po vyhľadaní prvku v periodickej tabuľke uvidíte atómovú hmotnosť priamo pod ikonou prvku.- Napríklad kubický atóm kyslíka je 15,99.
Vypočítajte molekulovú hmotnosť. Hmotnostná molekula látky sa rovná počtu atómov každého prvku vynásobenému hmotnostným atómom tohto prvku. Toto množstvo je nevyhnutné pri prepočte na gramy.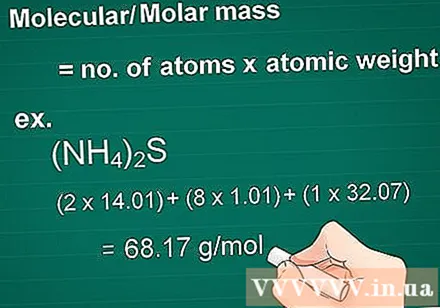
- Najskôr vynásobte atómové číslo každého prvku v zlúčenine jeho hmotnostným atómom.
- Potom spojte masy prvkov v zlúčenine.
- Príklad: Molekulová hmotnosť zlúčeniny (NH4)2S = (2 x 14,01) + (8 x 1,01) + (1 x 32,07) = 68,17 g / mol.
- Molekulová hmotnosť je tiež známa ako molárna hmotnosť.
Časť 2 z 2: Preveďte gramy na mol
Nastavte prevodný vzorec. Ak chcete zistiť počet mólov zlúčeniny, vydelte počet gramov zlúčeniny molárnou hmotnosťou tejto zlúčeniny.
- Vzorec: počet mólov = hmotnosť (gramy) / molárna hmotnosť zlúčeniny (gram / mol)
Nahraďte čísla do vzorca. Po nastavení správneho vzorca je ďalším krokom nahradenie čísel, ktoré ste vypočítali, svojim vzorcom. Ak sa chcete ubezpečiť, že sú údaje v správnej polohe, môžete ich skontrolovať potlačením jednotky. Ak po jednoduchosti zostávajúca jednotka sú krtky, ste nastavený správne.
Vyriešte rovnicu. Pomocou kalkulačky vydelte hmotnosť kubickou molekulou látky alebo zlúčeniny. Kvocientom bude počet mólov látky alebo zlúčeniny, ktoré hľadáte.
- Napríklad problém je v prípade 2 g vody (H2O) a požiada vás o prevedenie na molárne jednotky. Máme molárnu hmotnosť H2O je 18 g / mol. Rozdelte 2 na 18, aby ste mali 0,1111 mol H2O.
Rada
- Nezabudnite do odpovedí zahrnúť názov prvku alebo zlúčeniny.
- Ak sa od vás žiada, aby ste predstavili cvičenie alebo kvíz, nezabudnite svoje odpovede zreteľne ukázať krúžením alebo nakreslením poľa okolo odpovedí.
Čo potrebuješ
- Chemická periodická sústava
- Ceruzka
- Papier
- Počítač
- Problémy s chémiou



