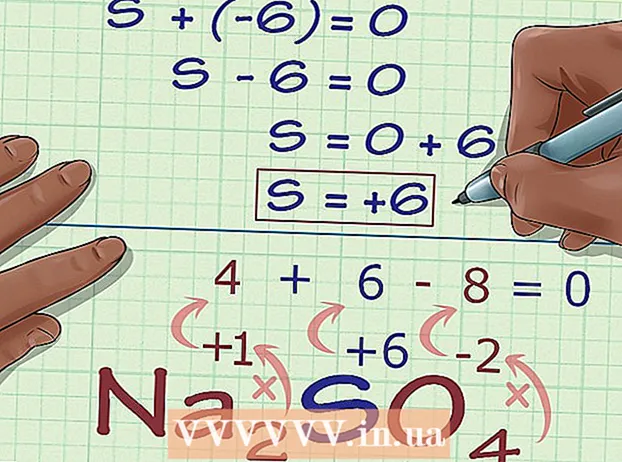
Obsah
- Na krok
- Časť 1 z 2: Priraďovanie oxidačných čísel na základe chemických pravidiel
- Časť 2 z 2: Priraďovanie čísel atómom bez pravidiel pre oxidačné čísla
- Tipy
- Nevyhnutnosť
V chémii výrazy „oxidácia“ a „redukcia“ znamenajú tie reakcie, pri ktorých atóm (alebo skupina atómov) stratí alebo získa elektróny. Oxidačné čísla sú čísla priradené atómom (alebo skupinám atómov), ktoré chemikom pomáhajú kontrolovať, koľko elektrónov je k dispozícii na vytesnenie a či dané reaktanty počas reakcie oxidujú alebo redukujú. Proces prideľovania oxidačných čísel atómom sa môže pohybovať od veľmi jednoduchého po zložitejší, v závislosti od náboja atómov a chemického zloženia molekúl, ktorých sú súčasťou. Aby to nebolo také jednoduché, niektoré atómy môžu mať viac oxidačných čísel. Našťastie sa priraďovanie oxidačných čísel riadi jasne definovanými a ľahko dodržiavateľnými pravidlami, ale základné pochopenie chémie a algebry použitie týchto pravidiel výrazne uľahčí.
Na krok
Časť 1 z 2: Priraďovanie oxidačných čísel na základe chemických pravidiel
 Zistite, či je daná látka živelná. Voľné neviazané atómy majú vždy oxidačné číslo 0. Platí to pre oba atómy, ktoré pozostávajú z jedného atómu, a pre atómy, ktorých elementárna forma je dvojatómová alebo viacatómová.
Zistite, či je daná látka živelná. Voľné neviazané atómy majú vždy oxidačné číslo 0. Platí to pre oba atómy, ktoré pozostávajú z jedného atómu, a pre atómy, ktorých elementárna forma je dvojatómová alebo viacatómová. - Napríklad Als a Cl2 obidve majú oxidačné číslo 0, pretože nie sú atómami zlúčeniny.
- Všimnite si, že síra v elementárnej forme, S.8 (oktasulfur), aj keď je nepravidelný, má tiež oxidačné číslo 0.
 Určite, či je príslušná látka ión. Ióny majú oxidačné čísla rovné ich náboju. To platí pre neviazané ióny aj pre ióny, ktoré sú súčasťou zloženého iónu.
Určite, či je príslušná látka ión. Ióny majú oxidačné čísla rovné ich náboju. To platí pre neviazané ióny aj pre ióny, ktoré sú súčasťou zloženého iónu. - Napríklad ión Cl má oxidačné číslo -1.
- Cl ión stále má oxidačné číslo -1, ak je súčasťou zlúčeniny NaCl. Pretože Na ión má podľa definície náboj +1, vieme, že ión Cl má náboj -1, takže oxidačné číslo je stále -1.
 V prípade iónov kovov je dobré mať na pamäti, že je možné dosiahnuť viac oxidačných čísel. Mnoho kovov môže mať viac ako jedno pristátie. Napríklad kovovým železom (Fe) môže byť ión s nábojom +2 alebo +3. náboj kovových iónov (a tým aj ich oxidačné čísla) možno určiť vo vzťahu k náboju ostatných atómov, v zložení ktorých sú súčasťou, alebo, ak sa to píše ako text, zápisom v rímskych čísliciach (napríklad v veta: „Ión železa (III) má náboj +3.“).
V prípade iónov kovov je dobré mať na pamäti, že je možné dosiahnuť viac oxidačných čísel. Mnoho kovov môže mať viac ako jedno pristátie. Napríklad kovovým železom (Fe) môže byť ión s nábojom +2 alebo +3. náboj kovových iónov (a tým aj ich oxidačné čísla) možno určiť vo vzťahu k náboju ostatných atómov, v zložení ktorých sú súčasťou, alebo, ak sa to píše ako text, zápisom v rímskych čísliciach (napríklad v veta: „Ión železa (III) má náboj +3.“). - Napríklad sa pozrime bližšie na zlúčeninu, ktorá obsahuje ión hliníka. Zlúčenina AlCl3 má náboj 0. Pretože vieme, že ióny Cl majú náboj -1 a v zlúčenine sú prítomné 3 ióny Cl, musí mať Al-ión náboj +3, takže náboj všetkých iónov sčítaných je 0. Takže oxidačné číslo Al je +3.
 Kyslíku (s výnimkami) priraďte oxidačné číslo -2. V takmer vo všetkých prípadoch majú atómy kyslíka oxidačné číslo -2. Z tohto pravidla existuje niekoľko výnimiek:
Kyslíku (s výnimkami) priraďte oxidačné číslo -2. V takmer vo všetkých prípadoch majú atómy kyslíka oxidačné číslo -2. Z tohto pravidla existuje niekoľko výnimiek: - Keď je kyslík v elementárnom stave (O2), potom sa oxidačné číslo rovná 0, čo je prípad všetkých základných atómov.
- Keď je kyslík súčasťou peroxid, potom je oxidačné číslo -1. Peroxidy sú triedou zlúčenín, ktoré majú väzbu kyslík-kyslík (alebo peroxidový anión O2). Napríklad v molekule H2O2 (peroxid vodíka), kyslík má oxidačné číslo (a náboj) -1. Tiež, keď je kyslík súčasťou superoxidu, oxidačné číslo je -0,5.
- Keď je kyslík viazaný na fluór, oxidačné číslo je +2. Ďalšie informácie nájdete v pravidle fluóru nižšie. V (O.2F.2) toto je +1.
 Priraďte vodíku oxidačné číslo +1 (s výnimkami). Rovnako ako v prípade kyslíka, oxidačné číslo vodíka závisí od výnimočných prípadov. Všeobecne má vodík oxidačné číslo +1 (s výnimkou elementárnej formy H.2). Ale v prípade špeciálnej zlúčeniny zvanej hybridy má vodík oxidačné číslo -1.
Priraďte vodíku oxidačné číslo +1 (s výnimkami). Rovnako ako v prípade kyslíka, oxidačné číslo vodíka závisí od výnimočných prípadov. Všeobecne má vodík oxidačné číslo +1 (s výnimkou elementárnej formy H.2). Ale v prípade špeciálnej zlúčeniny zvanej hybridy má vodík oxidačné číslo -1. - Napríklad od H2Vieme, že vodík má oxidačné číslo +1, pretože kyslík má náboj -2 a na výrobu zlúčeniny s celkovým nábojom nula potrebujeme náboje 2 +1. Ale s látkou hydrid sodný, NaH, má vodík oxidačné číslo -1, pretože ión Na má náboj +1 a aby bol celkový náboj zlúčeniny 0, vodík má náboj (a teda oxidačné číslo) -1.
 Fluór vždy oxidačné číslo -1. Ako je uvedené vyššie, oxidačné čísla určitých prvkov sa môžu meniť v dôsledku rôznych faktorov (ióny kovov, atómy kyslíka v peroxidoch atď.). Na druhej strane fluór má oxidačné číslo -1, a to sa nikdy nemení. Je to tak preto, lebo fluór je najviac elektro-negatívnym prvkom, alebo inými slovami, je to prvok, ktorý je najmenej ochotný vzdať sa elektrónov a s najväčšou pravdepodobnosťou prevezme elektróny z iných atómov. Preto sa oxidačné číslo nezmení.
Fluór vždy oxidačné číslo -1. Ako je uvedené vyššie, oxidačné čísla určitých prvkov sa môžu meniť v dôsledku rôznych faktorov (ióny kovov, atómy kyslíka v peroxidoch atď.). Na druhej strane fluór má oxidačné číslo -1, a to sa nikdy nemení. Je to tak preto, lebo fluór je najviac elektro-negatívnym prvkom, alebo inými slovami, je to prvok, ktorý je najmenej ochotný vzdať sa elektrónov a s najväčšou pravdepodobnosťou prevezme elektróny z iných atómov. Preto sa oxidačné číslo nezmení.  Oxidačné čísla v zlúčenine sa rovnajú náboju zlúčeniny. Oxidačné čísla všetkých atómov v zlúčenine sa rovnajú náboju tejto zlúčeniny. Napríklad, ak zlúčenina nemá žiadny náboj, potom bude súčet všetkých oxidačných čísel nulový; ak je zlúčeninou polyatómový ión s nábojom -1, potom pridané oxidačné čísla musia byť -1 atď.
Oxidačné čísla v zlúčenine sa rovnajú náboju zlúčeniny. Oxidačné čísla všetkých atómov v zlúčenine sa rovnajú náboju tejto zlúčeniny. Napríklad, ak zlúčenina nemá žiadny náboj, potom bude súčet všetkých oxidačných čísel nulový; ak je zlúčeninou polyatómový ión s nábojom -1, potom pridané oxidačné čísla musia byť -1 atď. - Toto je dobrý spôsob, ako skontrolovať svoju odpoveď - ak sa spojené oxidačné čísla zlúčeniny nezhodujú s nábojom tejto zlúčeniny, potom viete, že ste urobili chybu.
Časť 2 z 2: Priraďovanie čísel atómom bez pravidiel pre oxidačné čísla
 Nájdite atómy bez pravidiel oxidačného čísla. Niektoré atómy nedodržiavajú pravidlá na zisťovanie oxidačných čísel. Ak atóm nie je v súlade s vyššie uvedenými pravidlami a nie ste si istí, aký je jeho náboj (napríklad ak je súčasťou väčšej zlúčeniny, takže jednotlivý náboj nie je známy), oxidačné číslo tohto atómu nájdete pomocou eliminácia. Najprv určíte, aká je oxidácia každého iného atómu v zlúčenine. Potom v rovnici vyriešite súčet neznámych na základe celkového náboja zlúčeniny.
Nájdite atómy bez pravidiel oxidačného čísla. Niektoré atómy nedodržiavajú pravidlá na zisťovanie oxidačných čísel. Ak atóm nie je v súlade s vyššie uvedenými pravidlami a nie ste si istí, aký je jeho náboj (napríklad ak je súčasťou väčšej zlúčeniny, takže jednotlivý náboj nie je známy), oxidačné číslo tohto atómu nájdete pomocou eliminácia. Najprv určíte, aká je oxidácia každého iného atómu v zlúčenine. Potom v rovnici vyriešite súčet neznámych na základe celkového náboja zlúčeniny. - Napríklad v zlúčenine Na2TAK4, náboj síry (S) nie je známy - nie je to v elementárnej forme, takže to nie je 0, ale to je všetko, čo vieme. Je to vhodný kandidát na použitie tejto metódy na algebraické stanovenie oxidačného čísla.
 Určte známe oxidačné čísla ostatných prvkov v zlúčenine. Pomocou pravidiel priradenia oxidačného čísla určíme, ktoré oxidačné čísla majú ďalšie atómy v zlúčenine. Uvedomte si výnimky ako O, H atď.
Určte známe oxidačné čísla ostatných prvkov v zlúčenine. Pomocou pravidiel priradenia oxidačného čísla určíme, ktoré oxidačné čísla majú ďalšie atómy v zlúčenine. Uvedomte si výnimky ako O, H atď. - V Na2TAK4, na základe našej sady pravidiel vieme, že ión Na má náboj (a teda oxidačné číslo) +1 a že atómy kyslíka majú oxidačné čísla -2.
 Vynásobte počet jednotlivých atómov oxidačným číslom. Teraz, keď poznáme oxidačné čísla všetkých atómov okrem neznámych, budeme musieť vziať do úvahy, že niektoré z týchto atómov sa môžu vyskytovať viackrát. Vynásobte každý koeficient (napísaný v dolnom indexe za symbolom atómu v zlúčenine) oxidačným číslom.
Vynásobte počet jednotlivých atómov oxidačným číslom. Teraz, keď poznáme oxidačné čísla všetkých atómov okrem neznámych, budeme musieť vziať do úvahy, že niektoré z týchto atómov sa môžu vyskytovať viackrát. Vynásobte každý koeficient (napísaný v dolnom indexe za symbolom atómu v zlúčenine) oxidačným číslom. - Pokiaľ ide o Na2TAK4, vieme, že existujú 2 atómy Na a 4 atómy. Teraz urobíme nasledujúci výpočet, 2 × +1, aby sme dostali oxidačné číslo Na, 2, a vynásobíme 4 × -2, oxidačné číslo O, -8.
 Sčítajte výsledky. Sčítaním výsledkov týchto násobení získate oxidačné číslo zlúčeniny, bez s prihliadnutím na oxidačné číslo neznámeho atómu.
Sčítajte výsledky. Sčítaním výsledkov týchto násobení získate oxidačné číslo zlúčeniny, bez s prihliadnutím na oxidačné číslo neznámeho atómu. - V našom príklade s Na2TAK4, pridáme 2 až -8, aby sme dostali -6.
 Vypočítajte neznáme oxidačné číslo na základe náboja zlúčeniny. Teraz máte všetky údaje na nájdenie neznámeho oxidačného čísla pomocou jednoduchej algebry. Použijeme rovnicu a odpoveď z predchádzajúceho kroku plus náboj zlúčeniny. Inými slovami: (Súčet neznámych oxidačných čísel) + (neznáme oxidačné číslo, ktoré chcete vedieť) = (náboj zlúčeniny).
Vypočítajte neznáme oxidačné číslo na základe náboja zlúčeniny. Teraz máte všetky údaje na nájdenie neznámeho oxidačného čísla pomocou jednoduchej algebry. Použijeme rovnicu a odpoveď z predchádzajúceho kroku plus náboj zlúčeniny. Inými slovami: (Súčet neznámych oxidačných čísel) + (neznáme oxidačné číslo, ktoré chcete vedieť) = (náboj zlúčeniny).- V príklade Na2TAK4, riešime to nasledovne:
- (Súčet známych oxidačných čísel) + (neznáme oxidačné číslo, ktoré chcete vyriešiť) = (náboj zlúčeniny)
- -6 + S = 0
- S = 0 + 6
- S = 6. S má oxidačné číslo alebo 6 v Na2TAK4.
- V príklade Na2TAK4, riešime to nasledovne:
Tipy
- Atómy v základnej forme majú vždy oxidačné číslo 0. Ión, ktorý sa skladá z 1 atómu, má oxidačné číslo rovné náboju. Kovy skupiny 1A, ako sú vodík, lítium a sodík, majú oxidačné číslo +1; Kovy skupiny 2A, ako je horčík a vápnik, majú oxidačné číslo +2. Vodík aj kyslík môžu mať 2 rôzne oxidačné čísla, v závislosti od ich väzby.
- V zlúčenine by sa súčet všetkých oxidačných čísel mal rovnať 0. Ak existuje ión s 2 atómami, potom by sa súčet oxidačných čísel mal rovnať náboju iónu.
- Je veľmi užitočné vedieť čítať periodickú tabuľku a kde nájsť kovy a nekovy.
Nevyhnutnosť
- Periodická tabuľka prvkov
- Pripojenie na internet
- Kniha o chémii
- Papier, pero alebo ceruzka
- Kalkulačka