Autor:
Virginia Floyd
Dátum Stvorenia:
6 August 2021
Dátum Aktualizácie:
1 V Júli 2024
Obsah
- Kroky
- Metóda 1 z 3: Základy
- Metóda 2 z 3: Stanovenie typu väzby elektronegativitou
- Metóda 3 z 3: Výpočet Mullikenovej elektronegativity
- Tipy
V chémii je elektronegativita schopnosť atómov priťahovať k nim elektróny z iných atómov. Atóm s vysokou elektronegativitou silne priťahuje elektróny a atóm s nízkou elektronegativitou priťahuje elektróny slabo. Hodnoty elektronegativity sa používajú na predpovedanie správania rôznych atómov v chemických zlúčeninách.
Kroky
Metóda 1 z 3: Základy
 1 Chemické väzby. Takéto väzby vznikajú, keď elektróny v atómoch navzájom interagujú, to znamená, že dva elektróny (jeden z každého atómu) sa stávajú bežnými.
1 Chemické väzby. Takéto väzby vznikajú, keď elektróny v atómoch navzájom interagujú, to znamená, že dva elektróny (jeden z každého atómu) sa stávajú bežnými. - Opis dôvodov interakcie elektrónov v atómoch presahuje rámec tohto článku.Ak chcete získať ďalšie informácie o tejto téme, prečítajte si napríklad tento článok.
 2 Účinok elektronegativity. Keď si dva atómy navzájom priťahujú elektróny, sila príťažlivosti nie je rovnaká. Atóm s vyššou elektronegativitou priťahuje dva elektróny silnejšie. Atóm s veľmi vysokou elektronegativitou priťahuje elektróny takou silou, že už nehovoríme o zdieľaných elektrónoch.
2 Účinok elektronegativity. Keď si dva atómy navzájom priťahujú elektróny, sila príťažlivosti nie je rovnaká. Atóm s vyššou elektronegativitou priťahuje dva elektróny silnejšie. Atóm s veľmi vysokou elektronegativitou priťahuje elektróny takou silou, že už nehovoríme o zdieľaných elektrónoch. - Napríklad v molekule NaCl (chlorid sodný, obyčajná soľ) má atóm chlóru pomerne vysokú elektronegativitu a atóm sodíka je pomerne nízky. Takže elektróny sú priťahované k atómu chlóru a odpudzujú atómy sodíka.
 3 Elektronegatívna tabuľka. Táto tabuľka obsahuje chemické prvky usporiadané rovnakým spôsobom ako v periodickej tabuľke, ale pre každý prvok je daná elektronegativita jej atómov. Takúto tabuľku nájdete v učebniciach chémie, referenčných materiáloch a na internete.
3 Elektronegatívna tabuľka. Táto tabuľka obsahuje chemické prvky usporiadané rovnakým spôsobom ako v periodickej tabuľke, ale pre každý prvok je daná elektronegativita jej atómov. Takúto tabuľku nájdete v učebniciach chémie, referenčných materiáloch a na internete. - Nájdete tu vynikajúcu tabuľku elektronegativity. Všimnite si toho, že používa Paulingovu elektronegatívnu stupnicu, ktorá je najbežnejšia. Existujú však aj iné spôsoby výpočtu elektronegativity, z ktorých jeden bude diskutovaný nižšie.
 4 Trendy elektronegativity. Ak nemáte po ruke tabuľku elektronegativity, môžete odhadnúť elektronegativitu atómu podľa umiestnenia prvku v periodickej tabuľke.
4 Trendy elektronegativity. Ak nemáte po ruke tabuľku elektronegativity, môžete odhadnúť elektronegativitu atómu podľa umiestnenia prvku v periodickej tabuľke. - Ako doprava prvok sa nachádza, viac elektronegativita jeho atómu.
- Ako vyššie prvok sa nachádza, viac elektronegativita jeho atómu.
- Atómy prvkov nachádzajúcich sa v pravom hornom rohu periodickej tabuľky majú teda najvyššiu elektronegativitu a najnižšie atómy prvkov nachádzajúcich sa v dolnom ľavom rohu.
- V našom prípade NaCl môžeme povedať, že chlór má vyššiu elektronegativitu ako sodík, pretože chlór sa nachádza napravo od sodíka.
Metóda 2 z 3: Stanovenie typu väzby elektronegativitou
 1 Vypočítajte rozdiel medzi elektronegativitami dvoch atómov, aby ste pochopili charakteristiky väzby medzi nimi. Za týmto účelom odpočítajte menšiu elektronegativitu od väčšej.
1 Vypočítajte rozdiel medzi elektronegativitami dvoch atómov, aby ste pochopili charakteristiky väzby medzi nimi. Za týmto účelom odpočítajte menšiu elektronegativitu od väčšej. - Uvažujme napríklad o molekule HF. Odpočítajte elektronegativitu vodíka (2.1) od elektronegativity fluóru (4.0): 4,0 - 2,1 = 1,9.
 2 Ak je rozdiel menší ako 0,5, potom je väzba kovalentná nepolárna, v ktorej sú elektróny priťahované takmer rovnakou silou. Takéto väzby sa tvoria medzi dvoma identickými atómami. Nepolárne spojenia je spravidla veľmi ťažké prerušiť. Atómy totiž zdieľajú elektróny, vďaka čomu je ich väzba stabilná. Na jeho zničenie je potrebné veľa energie.
2 Ak je rozdiel menší ako 0,5, potom je väzba kovalentná nepolárna, v ktorej sú elektróny priťahované takmer rovnakou silou. Takéto väzby sa tvoria medzi dvoma identickými atómami. Nepolárne spojenia je spravidla veľmi ťažké prerušiť. Atómy totiž zdieľajú elektróny, vďaka čomu je ich väzba stabilná. Na jeho zničenie je potrebné veľa energie. - Napríklad molekula O2 má tento typ pripojenia. Pretože dva atómy kyslíka majú rovnakú elektronegativitu, rozdiel medzi nimi je 0.
 3 Ak je rozdiel v rozsahu 0,5 - 1,6, potom je väzba kovalentne polárna. V tomto prípade jeden z dvoch atómov priťahuje elektróny silnejšie, a preto získa čiastočný negatívny náboj a druhý čiastočný kladný náboj. Táto nerovnováha náboja umožňuje molekule zúčastniť sa určitých reakcií.
3 Ak je rozdiel v rozsahu 0,5 - 1,6, potom je väzba kovalentne polárna. V tomto prípade jeden z dvoch atómov priťahuje elektróny silnejšie, a preto získa čiastočný negatívny náboj a druhý čiastočný kladný náboj. Táto nerovnováha náboja umožňuje molekule zúčastniť sa určitých reakcií. - Napríklad molekula H2O (voda) má tento typ väzby. Atóm O je elektronegatívnejší ako dva atómy H, takže kyslík silnejšie priťahuje elektróny a získava čiastočný negatívny náboj a vodík - čiastočný kladný náboj.
 4 Ak je rozdiel väčší ako 2,0, väzba je iónová. Ide o väzbu, v ktorej spoločný elektrónový pár prechádza prevažne k atómu s vyššou elektronegativitou, ktorý získava záporný náboj, a atóm s nižšou elektronegativitou získava kladný náboj. Molekuly s takýmito väzbami dobre reagujú s inými atómami a môžu byť dokonca zničené polárnymi atómami.
4 Ak je rozdiel väčší ako 2,0, väzba je iónová. Ide o väzbu, v ktorej spoločný elektrónový pár prechádza prevažne k atómu s vyššou elektronegativitou, ktorý získava záporný náboj, a atóm s nižšou elektronegativitou získava kladný náboj. Molekuly s takýmito väzbami dobre reagujú s inými atómami a môžu byť dokonca zničené polárnymi atómami. - Tento typ väzby má napríklad molekula NaCl (chlorid sodný).Atóm chlóru je taký elektronegatívny, že k sebe priťahuje oba elektróny a získa negatívny náboj a atóm sodíka získa kladný náboj.
- NaCl môže byť zničený polárnou molekulou, ako je H2O (voda). V molekule vody je vodíková strana molekuly kladná a kyslíková strana záporná. Ak zmiešate soľ s vodou, molekuly vody rozložia molekuly soli a spôsobia jej rozpustenie.
 5 Ak je rozdiel medzi 1,6 a 2,0, skontrolujte, či neobsahuje kov. Ak je v molekule prítomný atóm kovu, potom je väzba iónová. Ak v molekule nie sú žiadne atómy kovu, potom je väzba polárne kovalentná.
5 Ak je rozdiel medzi 1,6 a 2,0, skontrolujte, či neobsahuje kov. Ak je v molekule prítomný atóm kovu, potom je väzba iónová. Ak v molekule nie sú žiadne atómy kovu, potom je väzba polárne kovalentná. - Kovy sú umiestnené vľavo a v strede periodickej tabuľky. V tejto tabuľke sú zvýraznené kovy.
- V našom prípade HF rozdiel medzi elektronegativitami spadá do tohto rozsahu. Pretože H a F nie sú kovy, väzba polárny kovalentný.
Metóda 3 z 3: Výpočet Mullikenovej elektronegativity
 1 Nájdite prvú ionizačnú energiu atómu. Mullikenova stupnica elektronegativity sa mierne líši od Paulingovej stupnice uvedenej vyššie. Prvá ionizačná energia je potrebná na odstránenie jedného atómu z elektrónu.
1 Nájdite prvú ionizačnú energiu atómu. Mullikenova stupnica elektronegativity sa mierne líši od Paulingovej stupnice uvedenej vyššie. Prvá ionizačná energia je potrebná na odstránenie jedného atómu z elektrónu. - Význam tejto energie možno nájsť v referenčných knihách o chémii alebo na internete, napríklad tu.
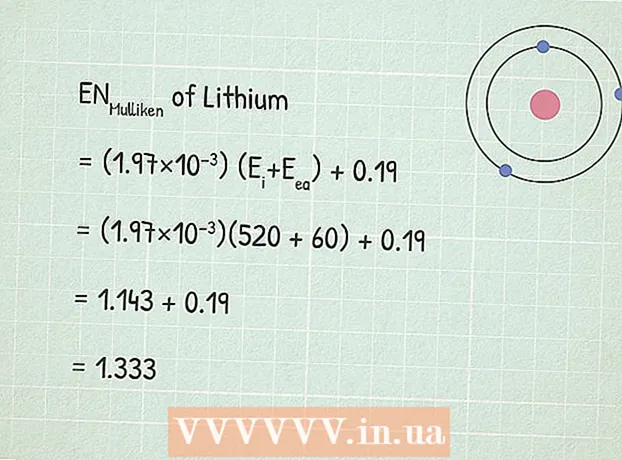
- Ako príklad nájdeme elektronegativitu lítia (Li). Jeho prvá ionizačná energia je 520 kJ / mol.
 2 Nájdite energiu afinity k elektrónu. Je to energia uvoľnená v procese pripojenia elektrónu k atómu. Význam tejto energie možno nájsť v referenčných knihách o chémii alebo na internete, napríklad tu.
2 Nájdite energiu afinity k elektrónu. Je to energia uvoľnená v procese pripojenia elektrónu k atómu. Význam tejto energie možno nájsť v referenčných knihách o chémii alebo na internete, napríklad tu. - Elektrónová afinitná energia lítia je 60 kJ / mol.
 3 Použite Mullikenovu rovnicu elektronegativity:RUMulliken = (1,97 × 10) (Ei+ Eea) + 0,19.
3 Použite Mullikenovu rovnicu elektronegativity:RUMulliken = (1,97 × 10) (Ei+ Eea) + 0,19. - V našom prípade:
- RUMulliken = (1,97 × 10) (Ei+ Eea) + 0,19
- RUMulliken = (1,97×10)(520 + 60) + 0,19
- RUMulliken = 1,143 + 0,19 = 1,333
- V našom prípade:
Tipy
- Okrem Paulingovej a Mullikenovej stupnice existujú ešte stupnice elektronegativity podľa Allred-Rochowa, Sandersona, Allena. Všetci majú svoje vlastné vzorce na výpočet elektronegativity (niektoré z nich sú dosť komplikované).
- Elektronegativita nemá jednotky merania.