Autor:
Randy Alexander
Dátum Stvorenia:
25 Apríl 2021
Dátum Aktualizácie:
24 V Júni 2024
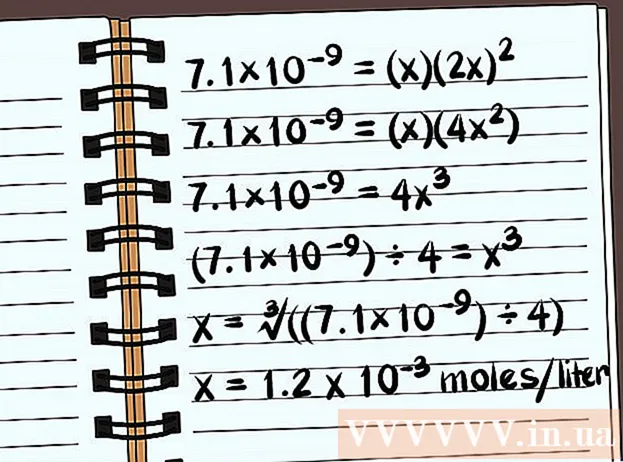
Obsah
V chémii sa rozpustnosť používa na opísanie vlastností tuhej zlúčeniny, keď je úplne rozpustená v kvapaline bez toho, aby zanechal akýkoľvek nerozpustný zvyšok. Rozpustné sú iba iónové zlúčeniny (nabité). V skutočnosti si stačí zapamätať niekoľko pravidiel alebo vyhľadať literatúru, aby ste vedeli, či iónová zlúčenina zostane po pridaní do vody pevná, alebo či sa veľké množstvo rozpustí. V skutočnosti sa určité množstvo molekúl rozpustí, aj keď nevidíte žiadne zmeny, takže aby bol experiment presný, musíte vedieť, ako toto množstvo rozpustenej látky vypočítať.
Kroky
Metóda 1 z 2: Používajte rýchle pravidlá
Dozviete sa viac o iónových zlúčeninách. Každý atóm má zvyčajne určitý počet elektrónov, ale niekedy elektrón dostane alebo ho rozdá. Tento proces ho robí jedným ióny spoplatnené. Keď sa ión so záporným nábojom (prebytok jedného elektrónu) stretne s iónom s kladným nábojom (chýba elektrón), spoja sa spolu ako katóda a anóda dvoch magnetov. Výsledkom je iónová zlúčenina.
- Ióny majú tzv. Záporný náboj aniónya ióny majú tzv. kladný náboj katión.
- Normálne sa počet elektrónov v atóme rovná počtu protónov, takže nemá žiadny náboj.

Pochopte rozpustnosť. Molekula vody (H2O) má nepravidelnú štruktúru, takže pripomína magnet: jeden koniec má kladný náboj a druhý záporný náboj. Keď dáte iónovú zlúčeninu do vody, tieto vodné „magnety“ sa zhromaždia okolo nej a snažia sa od seba od seba odtrhnúť kladné a záporné ióny.- Niektoré iónové zlúčeniny nie sú veľmi tesne absorbované, uvažuje sa o nich rozpustný Pretože sa po pridaní do vody oddelí a rozpustí. Ostatné zlúčeniny majú silnejšie väzby nerozpustný pretože ióny sú navzájom pevne priťahované bez ohľadu na príťažlivosť molekuly vody.
- Niektoré zlúčeniny majú väzbovú silu ekvivalentnú príťažlivosti molekuly vody. Berú sa do úvahy slabo rozpustný pretože väčšina zlúčenín bude oddelená, ale zvyšok bude stále priťahovaný navzájom.

Pochopte princíp rozpúšťania. Pretože interakcie medzi atómami sú také zložité, nemôžete sa úplne spoliehať na intuíciu, aby ste rozlíšili, ktoré zlúčeniny môžu alebo nemôžu. Vyhľadajte prvé spoločné ióny v zlúčenine na zozname nižšie a nájdite ich spoločné vlastnosti. Potom skontrolujte výnimky, aby ste zabezpečili, že druhý ión s ním nebude abnormálne interagovať.- Napríklad na kontrolu chloridu strontnatého (SrCl2), prosím, vyhľadajte Sr alebo Cl v tučných krokoch nižšie. Cl je „zvyčajne rozpustný“, preto si pod ním skontrolujte výnimky. Sr nie je na zozname výnimiek, takže SrCl2 musí byť rozpustný.
- Najbežnejšie výnimky z každého pravidla sú uvedené pod týmto pravidlom. Existujú aj ďalšie výnimky, ale je nepravdepodobné, že by sa vyskytli počas normálnej chémie alebo laboratórnych hodín.

Zlúčeniny sú rozpustné, ak obsahujú alkalické kovy, ako sú Li, Na, K, Rb a Cs. Tieto kovy sú tiež známe ako prvky skupiny IA: lítium, sodík, draslík, rubídium a cézium. Takmer všetky zlúčeniny obsahujúce jeden z týchto iónov sú rozpustné.- Výnimka: Li3PO4 nerozpustný.
ŽIADNE zlúčeniny3, C.2H3O2, NO2ClO3 a ClO4 všetky sú rozpustné. Názvy zodpovedajúce vyššie uvedeným iónom sú dusičnan, octan, dusitany, chlorečnany a chloristany. Všimnite si, že acetát je často označovaný skratkou OAc.
- Výnimka: Ag (OAc) (octan strieborný) a Hg (OAc)2 (octan ortuťnatý) nerozpustný.
- AgNO2 a KClO4 iba „mierne roztavené“.
Zlúčeniny Cl, Br a I sú zvyčajne rozpustné. Chloridové, bromidové a jodidové ióny takmer vždy tvoria rozpustné zlúčeniny, ktoré sa nazývajú halogénové soli.
- Výnimka: Ak sa niektorý z vyššie uvedených iónov kombinuje s iónmi striebra Ag, ortuti Hg2alebo Pb olovo bude tvoriť nerozpustné zlúčeniny. To isté platí pre menej bežné zlúčeniny tvorené kombináciou s meďou Cu a tali Tl.
Zlúčeniny obsahujúce SO4 zvyčajne rozpustný. Síranové ióny často tvoria rozpustné zlúčeniny, ale existuje veľa výnimiek.
- Výnimka: Síranové ióny tvoria nerozpustnú zlúčeninu s nasledujúcimi iónmi: stroncium Sr, bárium Ba, olovo Pb, striebro Ag, vápnik Ca, rádium Ra a atómy striebra Ag2. Upozorňujeme, že síran strieborný a síran vápenatý sú iba mierne rozpustné, takže ich niektorí považujú za málo rozpustné.
Látky obsahujúce OH alebo S sú nerozpustné. Zodpovedajúce názvy týchto iónov sú hydroxidy a sulfidy.
- Výnimka: Pamätáte si alkalické kovy (skupina I-A) a ako radi tvoria rozpustné zlúčeniny? Li, Na, K, Rb a Cs všetky tvoria zlúčeniny, ktoré sú rozpustné s hydroxidovými alebo sulfidovými iónmi. Okrem toho hydroxidy tvoria soli, ktoré sú rozpustné s iónmi kovov alkalických zemín (skupina II-A): vápnik Ca, stroncium Sr a bárium Ba. Poznámka: Zlúčeniny vyrobené z hydroxidov a kovov alkalických zemín majú skutočne značný počet molekúl, ktoré zostávajú navzájom spojené, takže sa niekedy považujú za „mierne rozpustné“.
Zlúčeniny obsahujúce CO3 alebo PO4 nerozpustný. Posledná kontrola, či neobsahujú uhličitanové a fosfátové ióny, a uvidíte, či je vaša zlúčenina rozpustná.
- Výnimka: Tieto ióny tvoria zlúčeniny, ktoré sú rozpustné s alkalickými kovmi, ako sú Li, Na, K, Rb a Cs, ako aj s amónnym iónom NH4.
Metóda 2 z 2: Vypočítajte rozpustnosť z konštanty K.sp
Vyhľadajte konštantu produktu rozpustnosti Ksp. Táto konštanta je pre každú zlúčeninu iná, preto by ste si ju mali vyhľadať v grafe v učebnici alebo online. Pretože tieto hodnoty sú určené experimentálne a môžu sa medzi grafmi výrazne líšiť, je najlepšie použiť graf učebnice, ak je k dispozícii. Pokiaľ nie je uvedené inak, väčšina grafov predpokladá skúšobnú teplotu 25 ° C.
- Povedzme napríklad, že rozpúšťate jodid olovnatý pomocou vzorca PbI2, napíšeme konštantu jej súčinu rozpustnosti. Ak sa pozriete na graf na adrese bilbo.chm.uri.edu, použijete konštantu 7,1 × 10.
Napíš chemickú rovnicu. Prvý z nich určuje iónový separačný profil tejto zlúčeniny po rozpustení. Potom napíš rovnicu pomocou K.sp na jednej strane a ióny zložiek na druhej strane.
- Napríklad molekula PbI2 disociujte na ióny Pb, I a I. (Potrebujete iba poznať alebo skontrolovať náboj iónu, pretože všetky zlúčeniny sú vždy elektricky neutrálne).
- Napíš rovnicu 7,1 × 10 =
- Táto rovnica je konštanta rozpustnosti, ktorú môžete zistiť v grafe rozpustnosti pre 2 ióny. Pretože existujú 2 ióny, musí byť l- kvadratický.
Transformujte rovnice tak, aby používali premenné. Opíšte rovnicu pomocou bežných algebraických metód pomocou informácií, ktoré viete o počte molekúl a iónov. Nastavte x na hmotnosť zlúčeniny, ktorá sa má rozpustiť, a prepíšte rovnicu, kde x predstavuje počet jednotlivých iónov.
- V tomto príklade musíme prepísať rovnicu 7,1 × 10 =
- Pretože v zlúčenine je iba jeden olovený ión (Pb), počet rozpustených molekúl sa rovná počtu voľných iónov olova. Preto ho môžeme nastaviť na x.
- Pretože pre každý olovený ión existujú dva jódové ióny (I), nastavili sme počet atómov jódu na dvojnásobok.
- Teraz je rovnica 7,1 × 10 = (x) (2x)
Berte do úvahy bežné ióny, ak existujú. Tento krok vynechajte, ak rozpúšťate zlúčeninu v destilovanej vode. Ak je zlúčenina rozpustená v roztoku, ktorý už obsahuje jeden alebo viac zložkových iónov („bežné ióny“), rozpustnosť zlúčeniny sa významne zníži. Účinok všeobecných iónov bude najzrejmejší na takmer nerozpustných zlúčeninách a v takom prípade môžete predpokladať, že väčšina rovnovážnych iónov je tých, ktoré boli predtým v roztoku. Opíšte rovnicu a vypočítajte molárnu koncentráciu (mol na liter alebo M) iónov, ktoré sú už v roztoku, a nahraďte túto hodnotu premennou x, ktorú pre tento ión použijete.
- Napríklad, ak je zlúčenina jodidu olovnatého rozpustená v 0,2M roztoku chloridu olovnatého (PbCl)2), rovnicu prepíšeme na 7,1 × 10 = (0,2 M + x) (2x). Pretože 0,2 M je vyššia koncentrácia ako x, mohli by sme ju prepísať na 7,1 × 10 = (0,2 M) (2x).
Vyriešte rovnicu. Riešime pre x a poznáš rozpustnosť zlúčeniny. Do definície konštanty rozpustnosti musíte napísať svoju odpoveď ako počet mólov zlúčeniny rozpustených na liter vody. Možno budete musieť nájsť svoj počítač na nájdenie konečnej odpovede.
- Nasledujúcim príkladom je rozpustnosť v destilovanej vode bez akýchkoľvek bežných iónov.
- 7,1 × 10 = (x) (2x)
- 7,1 × 10 = (x) (4x)
- 7,1 × 10 = 4x
- (7,1 × 10) ÷ 4 = x
- x = ∛ ((7,1 × 10) ÷ 4)
- x = 1,2 x 10 mólov na liter sa rozpustí. Toto je veľmi malá hmotnosť, takže táto zlúčenina je takmer nerozpustná.
Čo potrebuješ
- Tabuľka konštánt produktu rozpustnosti zlúčeniny (K.sp)
Rada
- Ak máte experimentálne údaje o množstve rozpustených zlúčenín, môžete použiť rovnakú rovnicu na riešenie konštanty rozpustnosti K.sp.
Výstraha
- Nie je jednotný názor na definície týchto výrazov, ale chemici sa zhodujú na väčšine zlúčenín. Rad špeciálnych zlúčenín, v ktorých rozpustné aj nerozpustné molekuly tvoria významné zložky, každá s iným popisom týchto zlúčenín.
- Niektoré staré učebnice pozri NH4OH je rozpustná zlúčenina. To nie je pravda; Boli detegované malé množstvá NH iónov4 a OH, ale tieto dva ióny sa nemôžu kombinovať do zlúčenín.