Autor:
Randy Alexander
Dátum Stvorenia:
1 Apríl 2021
Dátum Aktualizácie:
1 V Júli 2024
Obsah
V chémii, valenčné elektróny sú elektróny umiestnené v najvzdialenejšej vrstve elektrónového obalu prvku. Stanovenie počtu valenčných elektrónov prvku je dôležitá zručnosť v chémii, pretože tieto informácie pomôžu určiť typy väzieb, ktoré môže prvok vytvárať. Určenie počtu valenčných elektrónov je možné ľahko vykonať pomocou periodickej tabuľky chemických prvkov.
Kroky
Časť 1 z 2: Vyhľadajte počet valenčných elektrónov pomocou periodickej tabuľky
S nepriechodným kovom
Majte jeden pripravený periodická tabuľka chemické prvky. Periodická tabuľka prvkov (skrátene periodická tabuľka) je farebne odlíšená viacbunková tabuľka, ktorá obsahuje všetky známe prvky a základné informácie o nich. tieto prvky. Na základe dostupných informácií v periodickej tabuľke môžeme určiť počet valenčných elektrónov prvku, ktorý skúmame. Periodická tabuľka je zvyčajne pripojená k učebnici. Môžete sa tiež odvolať na túto existujúcu interaktívnu periodickú tabuľku.

Očíslovajte každý stĺpec v periodickej tabuľke od 1 do 18. Zvyčajne v periodickej tabuľke budú mať všetky prvky v rovnakom stĺpci rovnaký počet valenčných elektrónov. Ak vaša periodická tabuľka ešte nemá očíslované stĺpce, urobte to sami tak, že ich zvislo zľava doprava očíslováte od 1 do 18. Vedecky sa každý stĺpec periodickej tabuľky nazýva jeden „skupina“.- Napríklad pre nepodpísanú periodickú tabuľku by sme mali číslo 1 nad prvkom Vodík (H), číslo 2 nad prvkom Beri (Be) a to isté by sme robili do 18 nad hélium (He ).

Určte polohu príslušného prvku. V tomto kroku určite polohu prvku, na ktorý sa pozeráte v periodickej tabuľke. Pozíciu prvku môžete nájsť na základe jeho chemického symbolu (písmeno v každej bunke), atómového čísla (číslo v ľavom hornom rohu každej bunky) alebo na základe informácií správy sú k dispozícii v periodickej tabuľke.- Napríklad musíme zistiť počet valenčných elektrónov prvku Uhlík (C). Atómové číslo prvku je 6. Uhlík je v hornej časti prvkov skupiny 14. V ďalšom kroku určíme počet valenčných elektrónov tohto prvku.
- V tejto časti budeme ignorovať Transition Metals, tj prvky v rozsahu skupín 3 až 12. Tieto prechodné kovy sa mierne líšia od ostatných, takže kroky sú Pokyny uvedené v tejto časti sa nevzťahujú na tieto kovy. Na tieto skupiny prvkov sa pozrieme ďalej v článku.

Pomocou čísla skupiny určte počet valenčných elektrónov. Skupinové číslo neprechodného kovu sa môže použiť na výpočet počtu valenčných elektrónov v atóme tohto prvku. „Jednotkový riadok čísla skupiny“ je počet valenčných elektrónov v atómoch prvkov v tejto skupine. Inými slovami:- Valenčný elektrón skupiny 1: 1
- Skupina 2: 2 valenčné elektróny
- Skupina 13: 3 valenčné elektróny
- Skupina 14: 4 valenčné elektróny
- Skupina 15: 5 valenčných elektrónov
- Skupina 16: 6 valenčných elektrónov
- Skupina 17: 7 valenčných elektrónov
- Skupina 18: 8 valenčných elektrónov (okrem hélia s 2 valenčnými elektrónmi)
- V príklade uhlíka, pretože uhlík je v skupine 14, by sme mohli povedať, že atóm uhlíka má štyri valenčné elektróny.
S prechodovým kovom
Identifikujte prvok v rozmedzí od skupiny 3 do skupiny 12. Ako už bolo spomenuté vyššie, prvky v skupinách 3 až 12 sa nazývajú „prechodné kovy“ a pokiaľ ide o valenčné elektróny, tieto majú odlišné vlastnosti od ostatných. V tejto časti sa dozvieme, prečo často nie je možné priradiť valenčné elektróny k atómom prechodných kovov.
- V tejto časti vezmeme ako príklad prvok Tantan (Ta), ktorého atómové číslo je 73. Ďalšie kroky pomôžu určiť počet valenčných elektrónov prvku.
- Upozorňujeme, že prvky z rodiny 3 lantánov a aktinia (tiež známe ako „kovy vzácnych zemín“) patria do skupiny prechodných kovov - tieto dve skupiny prvkov sú zvyčajne uvedené pod periodickou tabuľkou. hlava s lantanom a aktinami.
Valenčné elektróny v prechodných kovoch nie sú rovnaké ako „normálne“ valenčné elektróny. Aby sme pochopili, prečo prechodné kovy v skutočnosti „nepracujú“ ako iné prvky v periodickej tabuľke, potrebujeme vedieť niečo o tom, ako elektróny pracujú v atómoch, ako je vysvetlené nižšie. , alebo môžete tento krok preskočiť.
- Keď sú elektróny vložené do atómu, sú usporiadané do rôznych „orbitálov“ - teda do rôznych oblastí okolo jadra. Stručne povedané, valenčné elektróny sú elektróny umiestnené v najvzdialenejšej orbitálnej vrstve - inými slovami, posledné elektróny pridané k atómu.
- Podrobné vysvetlenie obežnej dráhy je možno trochu komplikované, keď sa do podtriedy pridajú elektróny d atómového obalu prechodného kovu (pozri nižšie), prvý z týchto elektrónov sa bude správať ako bežné valenčné elektróny, ale potom sa môžu ich vlastnosti meniť, zdvojnásobiť keď elektróny z iných orbitálov môžu pôsobiť ako valenčné elektróny. To znamená, že atóm môže mať viac valenčných elektrónov v závislosti od prípadu.
- Viac sa o tom dozviete na valenčnej elektronovej stránke Clackamas Community College.
Určte počet valenčných elektrónov na základe počtu skupín. Ako je uvedené vyššie v prípade neprechodných kovov, počet skupín v periodickej tabuľke môže pomôcť určiť počet valenčných elektrónov. Neexistuje však jednoznačný vzorec na stanovenie presného počtu valenčných elektrónov prechodného kovu - v tomto prípade počet valenčných elektrónov prvku nie je na pevnej hodnote, čo je počet vecí. vlastné skupiny môžu povedať iba relatívny počet valenčných elektrónov. Detail:
- Skupina 3: 3 valenčné elektróny
- Skupiny 4: 2 až 4 valenčných elektrónov
- Skupina 5: 2 až 5 valenčných elektrónov
- Skupina 6: 2 až 6 valenčných elektrónov
- Skupiny 7: 2 až 7 valenčných elektrónov
- Skupiny 8: 2 až 3 valenčných elektrónov
- Skupiny 9: 2 až 3 valenčné elektróny
- Skupiny 10: 2 až 3 valenčných elektrónov
- Skupiny 11: 1 až 2 valenčné elektróny
- Skupina 12: 2 valenčné elektróny
- Na príklade prvku Tanta (Ta) skupiny 5 môžeme povedať, že tento prvok má od 2 do 5 valenčných elektrónov, podľa prípadu.
Časť 2 z 2: Nájdite počet valenčných elektrónov na základe konfigurácie elektrónov
Naučte sa čítať konfiguráciu elektrónov. Na základe elektrónovej konfigurácie prvku môžeme tiež určiť počet valenčných elektrónov tohto prvku. Elektrónová konfigurácia vyzerá komplikovane, ale predstavuje spôsob, ako reprezentovať orbitaly prvku vo forme písmen a číslic, akonáhle pochopíte zákon, pochopenie elektrónovej konfigurácie nie je ťažké.
- Zvážte príklad elektrónovej konfigurácie sodíka (Na):
- 1s2s2p3s
- Ak budete venovať pozornosť, uvidíte, že elektrónová konfigurácia je iba reťazcom opakovaní:
- (číslo) (slovo) (číslo) (slovo) ...
- ... a tak ďalej. Skupina (číslo) (slovo) prvý je názov obežnej dráhy a označuje počet elektrónov v tejto obežnej dráhe.
- V našom prípade teda môžeme povedať, že sodík áno 2 elektróny na obežnej dráhe 1 s, 2 elektróny na obežnej dráhe 2 s, 6 elektrónov na obežnej dráhe 2p a 1 elektrón za 3 3 s na obežnej dráhe. Celkovo existuje 11 elektrónov - atómové číslo sodíka je tiež 11.
- Zvážte príklad elektrónovej konfigurácie sodíka (Na):
Nájdite elektrónovú konfiguráciu prvku, na ktorý sa pozeráte. Keď poznáte elektrónovú konfiguráciu prvku, nájdenie elektrónovej konfigurácie tohto prvku nie je ťažké (okrem prechodných kovov). Ak je v otázke, ktorú potrebujete vyriešiť, k dispozícii konfigurácia elektrónov, môžete tento krok preskočiť. Ak potrebujete zistiť konfiguráciu elektrónov, postupujte podľa nasledujúcich krokov:
- Kompletná elektrónová konfigurácia prvku ununocti (Uuo), atómového čísla 118, je:
- 1s2s2p3s3p4s3d4p5s4d5p6s4f5d6p7s5f6d7p
- Keď máte úplnú elektrónovú konfiguráciu, aby ste našli elektrónovú konfiguráciu iného prvku, stačí naplniť orbitaly elektrónmi, počnúc prvou obežnou dráhou, kým sa nevyčerpá počet elektrónov. Znie to komplikovane, ale keď to príde na to, je to pomerne ľahké. Napríklad, ak by sme chceli napísať úplnú elektrónovú konfiguráciu chlóru (Cl), prvok 17, to znamená, že atóm tohto prvku má 17 elektrónov, vyplnili by sme nasledujúce:
- 1s2s2p3s3p
- Všimnite si, že celkový počet elektrónov v elektrónovej konfigurácii je správny 17: 2 + 2 + 6 + 2 + 5 = 17. Musíte len zmeniť číslo na poslednej obežnej dráhe - zvyšok zostáva rovnaký, pretože predposledná obežná dráha je plná. elektrón.
- Prečítajte si viac informácií o tom, ako napísať elektrónovú konfiguráciu prvku.
- Kompletná elektrónová konfigurácia prvku ununocti (Uuo), atómového čísla 118, je:

Priraďte elektróny k orbitalom podľa ôsmeho pravidla. Keď sa elektróny pridajú k atómu, rozdelia sa na orbitaly v poradí uvedenom vyššie - prvé dva elektróny budú umiestnené na obežnej dráhe 1 s, ďalšie dva elektróny na obežnej dráhe 2 s, ďalších šesť elektrónov bude umiestnených do obežnej dráhy 2p, robte to tak dlho, kým sa elektrón nedostane na zodpovedajúci orbitál. Keď vezmeme do úvahy atómy neprechodných prvkov, môžeme povedať, že tieto orbitaly budú okolo jadra vytvárať „vrstvy“, v ktorých bude nasledujúca vrstva ďalej od jadra ako tá pred ním. Okrem prvej orbitálnej vrstvy, ktorá môže obsahovať iba dva elektróny, môžu všetky nasledujúce orbitálne vrstvy obsahovať až osem elektrónov (s výnimkou prechodných kovov). Toto pravidlo sa nazýva Osemnásobné pravidlo.- Zvážte napríklad prvok Bo (B). Atómové číslo tohto prvku je 5, takže máme elektrónovú konfiguráciu tohto prvku nasledovne: 1s2s2p. Pretože prvý orbitálny obal obsahuje iba 2 elektróny, je možné určiť, že Bo má dve orbitálne vrstvy: prvú, ktorá sa skladá z 2 elektrónov na obežnej dráhe 1 s, a druhú s tromi elektrónmi distribuovanými v orbitáloch 2 s a 2 p. .
- Pre ďalší príklad by prvok podobný chlóru mal 3 vrstvy: vrstvu dvoch elektrónov na obežnej dráhe 1 s, vrstvu dvoch elektrónov na obežnej dráhe 2 s a šesť elektrónov na obežnej dráhe 2 p a vonkajšiu vrstvu dvoch elektrónov na obežnej dráhe 3 s. a päť elektrónov v obežnej dráhe 3p.

Nájdite počet elektrónov v najvzdialenejšej vrstve. Po určení konfigurácie elektrónov už poznáme vrstvy tohto prvku. Počet valenčných elektrónov je možné zistiť zistením počtu elektrónov v najvzdialenejšej vrstve obalu atómového elektrónu. Ak je najvzdialenejšia vrstva plná (t. J. Už má celkom osem elektrónov alebo pre elektróny prvej vrstvy 2), je tento prvok známy ako inertný prvok a ťažko sa podieľa na chemických reakciách. Toto pravidlo sa však nevzťahuje na prechodné kovy.- Napríklad s prvkom Bo, pretože Bo má tri elektróny v druhej vrstve, tiež najvzdialenejšej vrstve, môžeme povedať, že prvok Bo má otec valenčné elektróny.

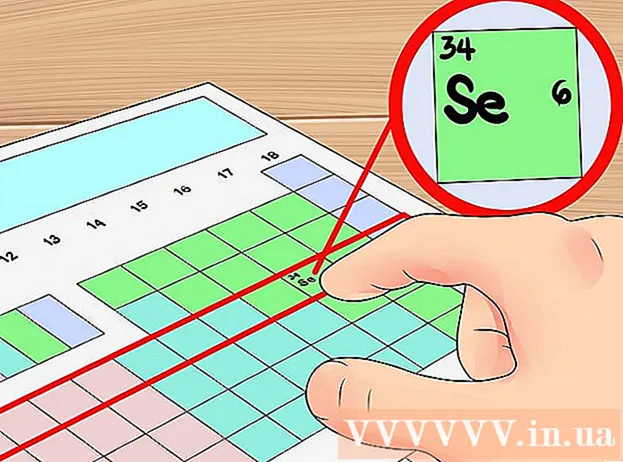
Použite číslo riadku v periodickej tabuľke ako skrátený spôsob na určenie počtu orbitálnych vrstiev. Zavolá sa vodorovný riadok na periodickej tabuľke „cyklus“ prvkov. Počnúc prvým riadkom každý cyklus zodpovedá „počtu elektrónových vrstiev“ prvkov v rovnakom období. Preto môžete pomocou periódy rýchlo určiť počet valenčných elektrónov prvku - spočítate iba počet elektrónov v poradí zľava doprava od prvého prvku tejto periódy. Ešte raz si uvedomte, že to neplatí pre prechodné kovy.- Napríklad, pretože selén patrí do cyklu 4, dá sa určiť, že prvok má v atómovom obale štyri elektrónové vrstvy. Pretože toto je, v poradí zľava doprava, je to šiesty prvok v cykle 4 (okrem prechodného kovu), môžeme povedať, že štvrtý obal selénu má šesť elektrónov, t. J. Tento prvok má šesť valenčných elektrónov.
Rada
- Upozorňujeme, že elektrónovú konfiguráciu možno stručne napísať pomocou vzácnych plynov (prvky skupiny 18) namiesto orbitálov v hornej časti konfigurácie. Napríklad elektrónovú konfiguráciu sodíka možno napísať ako 3s1 - to znamená, že elektrónová konfigurácia sodíka je rovnaká ako konfigurácia Neónov, ale v obežnej dráhe 3 s je elektrón navyše.
- Prechodné kovy môžu mať neúplné valenčné podtriedy. Aby bolo možné presne určiť valenčné číslo prechodného kovu, je potrebné použiť komplexné kvantové princípy, ktoré tento článok nepokrýva.
- Je tiež dôležité poznamenať, že periodická sústava chemických prvkov sa v rôznych krajinách môže líšiť. Uistite sa, že používate spoločnú periodickú tabuľku, kde žijete, aby ste predišli nedorozumeniam.
Čo potrebuješ
- Periodická tabuľka chemických prvkov
- Ceruzka
- Papier



