Autor:
Lewis Jackson
Dátum Stvorenia:
6 Smieť 2021
Dátum Aktualizácie:
1 V Júli 2024
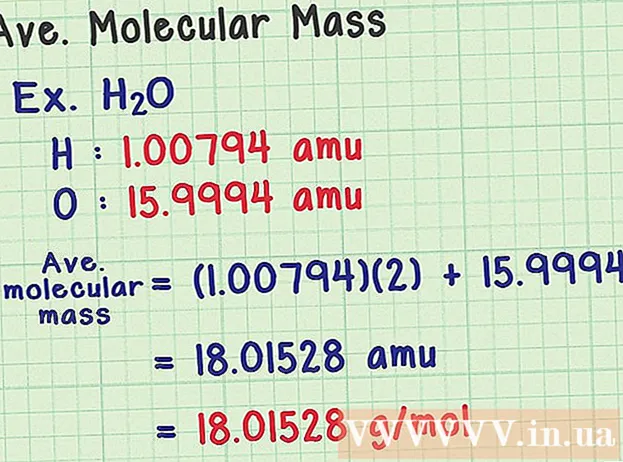
Obsah
Priemerná hmotnosť atómu nie je priamou mierou hmotnosti atómu. Namiesto toho je to priemerná hmotnosť na atóm z typickej vzorky prvku. Ak dokážete zmerať masy miliárd jednotlivých atómov, zistíte to výpočtom ich priemeru. Máme praktickejšiu metódu, ktorá je založená na informáciách o rôznych izotopoch chemického prvku.
Kroky
Časť 1 z 2: Vypočítajte priemernú hmotnosť atómu
Pochopte izotopy a masové atómy. V prírode existuje väčšina prvkov v mnohých formách alebo izotopoch. Jediným rozdielom medzi dvoma izotopmi toho istého prvku je počet neutrónov v atóme, ktorých počet neutrónov ovplyvňuje masový atóm. Výpočet priemernej hmotnosti atómu berie do úvahy vplyv tohto rozdielu a hovorí vám o priemernej hmotnosti každého atómu vo vzorke týchto atómov.
- Napríklad prvok striebro (Ag) má dva prírodné izotopy: Ag-107 a Ag-109 (alebo Ag a Ag). Izotop je pomenovaný podľa „hromadného čísla“ alebo súčtu počtu protónov a počtu neutrónov v atóme. To znamená, že Ag-109 má o dva neutróny viac ako Ag-107, takže jeho atóm je o niečo ťažší.

Nájdite hmotnosť každého izotopu. Pre každý izotop potrebujete dve informácie, môžete si ich vyhľadať v referenčných knihách alebo online, napríklad webelements.com. Prvý z nich je hmotnostný atóm alebo atómová hmotnosť každého izotopu. Izotopy s väčším počtom neutrónov majú väčšiu hmotnosť.- Napríklad izotop striebra Ag-107 má hmotný atóm 106 90509 amu (jednotka kubického atómu). Izotop Ag-109 je o niečo ťažší s hmotnosťou 108,90470.
- Dvojica desatinných miest na konci sa môže v dokumentoch mierne líšiť. Po skončení omše nepíšte žiadne čísla do zátvoriek.

Zapíšte si prirodzenú mieru prežitia pre každý izotop. Tento pomer označuje prevalenciu izotopu ako percento z celkových atómov prvku. Tieto informácie nájdete v rovnakom dokumente, v ktorom je uvedený kubický atóm. Prirodzené prežitie všetkých izotopov by malo byť 100% (aj keď sa môže mierne líšiť v dôsledku chyby zaokrúhľovania).- Izotop Ag-107 má pomer 51,86%. Izotop Ag-109 je menej častý pri miere 48,14%. To znamená, že normálna vzorka striebra má 51,86% Ag-107 a 48,14% Ag-109.
- Akýkoľvek izotop bez tejto miery prežitia je ignorovaný. Tieto izotopy na Zemi prirodzene neexistujú.

Preveďte percento izotopu na desatinné číslo. Vydeľte tento pomer 100 a získate rovnakú hodnotu ako desatinné miesto.- Vo vzorke striebra vyššie je pomer izotopov 51,86 / 100 = 0,5186 a 48,14 / 100 = 0,4814.
Nájdite priemerný kubický atóm. Priemerná hmotnosť atómu prvku má n izotopy rovnaké (Atómový blokIzotop 1 * pomerIzotop 1) + (atómová hmotnosťIzotop 2 * pomerIzotop 2) + ... + (atómová hmotnosťizotopy n * pomerizotopy n. Toto je príklad „priemernej hmotnosti“, čo znamená, že čím vyššia je miera prežitia izotopu, tým väčší je jeho vplyv na výsledok. Ako použiť tento vzorec pre striebro:
- Atóm strednej hmotnostiAg = (kubický atómAg-107 * pomerAg-107) + (atómová hmotnosťAg-109 * pomerAg-109)
=(106,90509 * 0,5186) + (108,90470 * 0,4814)
= 55,4410 + 52,4267
= 107,8677 amu. - Vyhľadajte tento prvok v periodickej tabuľke a skontrolujte výsledky. Priemerný kubický atóm je vždy napísaný pod chemickým symbolom prvku.
- Atóm strednej hmotnostiAg = (kubický atómAg-107 * pomerAg-107) + (atómová hmotnosťAg-109 * pomerAg-109)
Časť 2 z 2: Používanie výsledkov
Prepočítajte hmotnosť na atómové číslo. Priemerná hmotnosť atómu ukazuje vzťah medzi hmotnosťou a počtom atómov v typickej vzorke tohto prvku. To je veľmi užitočné v chemických laboratóriách, pretože je takmer nemožné presne spočítať atómy, ale hmotnosti sa dajú ľahko určiť. Napríklad by ste mohli odvážiť vzorku striebra a vedieť, že na každých 107 867 amu bude jeden atóm striebra.
Prevod na molárnu hmotnosť. Jednotka atómovej hmotnosti je veľmi malá, takže chemici často používajú jednotku hmotnosti pre hmotnosť. Našťastie máme definície týchto pojmov, takže transformácia by mala byť ľahká. Stačí vynásobiť priemerný hmotnostný atóm 1 g / mol (molárna hmotnostná konštanta) a získate výsledok v g / mol. Napríklad 107 867 gramov striebra obsahuje jeden mól atómov striebra.
Nájdite priemernú molekulovú hmotnosť. Pretože molekula je súborom atómov, môžete pridať hmotnosť všetkých atómov a zistiť tak molekulovú hmotnosť. Ak by ste použili priemernú hmotnosť atómu (namiesto hmotnosti konkrétneho izotopu), výsledkom by bola priemerná molekulová hmotnosť vzorky v prírode. Tu je príklad:
- Molekula vody má chemický vzorec H2O obsahuje dva atómy vodíka (H) a jeden atóm kyslíka (O).
- Vodík má priemerný hmotnostný atóm 1 00794 amu. Kyslík má priemernú atómovú hmotnosť 15,9994 amu.
- Takže priemerná molekulová hmotnosť H2O sa rovná (1,00794) (2) + 15,9994 = 18,01528 amu, čo zodpovedá 18,01528 g / mol.
Rada
- Pojem relatívna atómová hmotnosť sa niekedy používa ako synonymum priemerného hmotnostného atómu. Existuje malý rozdiel, pretože atómová hmotnosť je relatívne jednotková; je to meranie hmotnosti vzhľadom na atóm uhlíka-12. Pokiaľ použijete jednotku atómovej hmotnosti pri výpočte priemerného kubického atómu, sú tieto dve hodnoty rovnaké.
- Číslo v zátvorkách za kubickým atómom nám hovorí chybu. Napríklad hmotnostný atóm 1.0173 (4) znamená, že normálny atóm prvku má hmotnostný rozsah asi 1,0173 ± 0,0004. Toto číslo nemusíte získať, ak nie je požadované.
- V periodickej tabuľke je priemerný kubický atóm nasledujúceho prvku až na malé výnimky väčší ako pred ním. Tu je rýchly spôsob, ako skontrolovať svoje výsledky.
- 1 jednotka atómovej hmotnosti je 1/12 hmotnosti atómu uhlíka-12.
- Miera prežitia izotopov sa počíta podľa typických prirodzene sa vyskytujúcich vzoriek na Zemi. Prirodzene sa nevyskytujúce látky, ako napríklad meteority alebo látky vyrobené v laboratóriu, môžu mať rôzny pomer izotopov, takže priemerný hmotnostný atóm je tiež odlišný.
Výstraha
- Hmotnostné atómy sa vždy zapisujú v jednotkách atómovej hmotnosti (amu alebo u), niekedy sa nazývajú daltony (Da). Nikdy po tomto čísle nepíšte ďalšiu jednotku hmotnosti (napríklad kilogram) bez zmeny.
Čo potrebuješ
- Ceruzka
- Papier
- Notebook
- Údaje o miere prežitia izotopov v prírode.
- Údaje o hmotnostnej atómovej jednotke pre izotopy.



