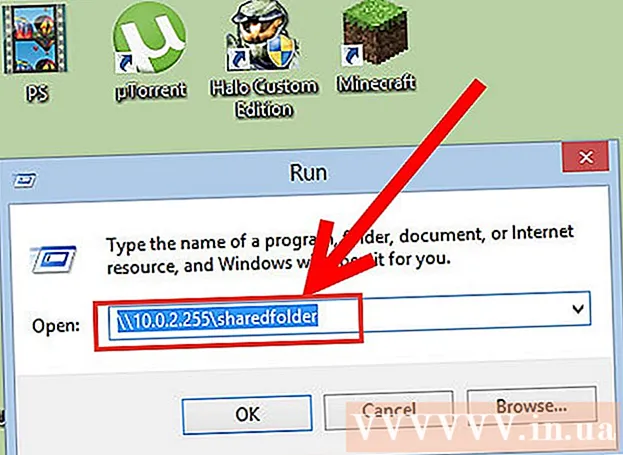
Autor:
Marcus Baldwin
Dátum Stvorenia:
20 V Júni 2021
Dátum Aktualizácie:
1 V Júli 2024

Obsah
- Kroky
- Metóda 1 z 5: Dobré študijné návyky
- Metóda 2 z 5: Pochopenie atomistickej štruktúry
- Metóda 3 z 5: Výpočet chemických reakcií
- Metóda 4 z 5: Výpočty
- Metóda 5 z 5: Jazyk chémie
- Tipy
Na úspešné zvládnutie skúšky zo všeobecnej chémie je dôležité ovládať základy predmetu, vedieť počítať, pri zložitejších problémoch používať kalkulačku a byť pripravený naučiť sa niečo nové. Chémia študuje látky a ich vlastnosti. Všetko okolo nás je o chémii, dokonca aj tých najjednoduchších veciach, ktoré považujeme za samozrejmé, ako je voda, ktorú pijeme, a vzduch, ktorý dýchame. Pripravte sa na objavy o všetkom, čo vás obklopuje. Spoznávanie chémie bude zábava.
Kroky
Metóda 1 z 5: Dobré študijné návyky
 1 Zoznámte sa so svojim učiteľom alebo učiteľom. Aby ste úspešne zvládli skúšku, mali by ste sa zoznámiť so svojim inštruktorom a povedať mu, čo je pre vás ťažké.
1 Zoznámte sa so svojim učiteľom alebo učiteľom. Aby ste úspešne zvládli skúšku, mali by ste sa zoznámiť so svojim inštruktorom a povedať mu, čo je pre vás ťažké. - Ak študenti potrebujú pomoc, na mnohých učiteľov sa dá prísť aj mimo vyučovania. Okrem toho majú spravidla metodické publikácie.
 2 Dajte dohromady skupinu, aby si precvičili. Nehanbite sa za to, že chémia je pre vás ťažká. Táto téma je ťažká takmer pre každého.
2 Dajte dohromady skupinu, aby si precvičili. Nehanbite sa za to, že chémia je pre vás ťažká. Táto téma je ťažká takmer pre každého. - Pri práci v skupine ľudia, ktorí rýchlo pochopia tému, ju vysvetlia ostatným. Rozdeľ a panuj.
 3 Prečítajte si príslušné odseky v návode. Učebnice chémie nie sú najnapínavejším čítaním, ale mali by ste si pozorne prečítať materiál a zvýrazniť text, ktorému nerozumiete. Vytvorte si zoznam otázok a konceptov, ktorým je ťažké porozumieť.
3 Prečítajte si príslušné odseky v návode. Učebnice chémie nie sú najnapínavejším čítaním, ale mali by ste si pozorne prečítať materiál a zvýrazniť text, ktorému nerozumiete. Vytvorte si zoznam otázok a konceptov, ktorým je ťažké porozumieť. - Vráťte sa do týchto končín neskôr s čerstvou hlavou. Ak vám to stále príde ťažké, prediskutujte tému v skupine alebo požiadajte o pomoc svojho učiteľa.
 4 Odpovedzte na otázky za odsekom. Aj keď je veľa materiálu, možno ste si toho zapamätali viac, ako si myslíte. Skúste odpovedať na otázky na konci kapitoly.
4 Odpovedzte na otázky za odsekom. Aj keď je veľa materiálu, možno ste si toho zapamätali viac, ako si myslíte. Skúste odpovedať na otázky na konci kapitoly. - Niekedy majú učebnice na konci vysvetľujúci materiál, ktorý popisuje správne riešenie. To vám pomôže pochopiť, kde ste urobili chybu v odôvodnení.
 5 Prezrite si grafy, obrázky a tabuľky. Učebnice používajú vizuálne prostriedky na prenos informácií.
5 Prezrite si grafy, obrázky a tabuľky. Učebnice používajú vizuálne prostriedky na prenos informácií. - Pozrite sa na obrázky a schémy. To vám umožní lepšie porozumieť niektorým pojmom.
 6 Požiadajte svojho inštruktora o povolenie nahrať prednášku na magnetofón. Je ťažké zapisovať si informácie a stále sa pozerať na tabuľu, najmä pokiaľ ide o tak zložitý predmet, akým je chémia.
6 Požiadajte svojho inštruktora o povolenie nahrať prednášku na magnetofón. Je ťažké zapisovať si informácie a stále sa pozerať na tabuľu, najmä pokiaľ ide o tak zložitý predmet, akým je chémia.  7 Pozrite sa na otázky z predchádzajúceho testu. Niekedy študenti dostanú otázky, s ktorými sa stretli na skúškach v predchádzajúcich rokoch, aby sa mohli lepšie pripraviť.
7 Pozrite sa na otázky z predchádzajúceho testu. Niekedy študenti dostanú otázky, s ktorými sa stretli na skúškach v predchádzajúcich rokoch, aby sa mohli lepšie pripraviť. - Nepamätajte si odpovede. Chémia je predmet, kde je na zodpovedanie otázky dôležité porozumieť tomu, o čo ide, a nielen opakovať zapamätaný text.
 8 Využite výhody online vzdelávacích zdrojov. Navštívte všetky stránky, ktoré odporúča váš inštruktor.
8 Využite výhody online vzdelávacích zdrojov. Navštívte všetky stránky, ktoré odporúča váš inštruktor.
Metóda 2 z 5: Pochopenie atomistickej štruktúry
 1 Začnite s najjednoduchšou stavbou. Na to, aby ste sa stali skúškou, budete potrebovať vedieť, z čoho je všetko vyrobené, čo je podstatou a má hmotnosť.
1 Začnite s najjednoduchšou stavbou. Na to, aby ste sa stali skúškou, budete potrebovať vedieť, z čoho je všetko vyrobené, čo je podstatou a má hmotnosť. - Všetko to začína pochopením štruktúry atómu. Všetko ostatné bude pridané zhora. Je dôležité veľmi starostlivo študovať všetky informácie o atóme.
 2 Pozrite sa na koncept atómu. Atóm je najmenšia „tehla“ zo všetkého, čo má hmotnosť, vrátane látok, ktoré nemôžeme vždy vidieť (napríklad plyny). Ale aj atóm obsahuje malé častice, ktoré tvoria jeho štruktúru.
2 Pozrite sa na koncept atómu. Atóm je najmenšia „tehla“ zo všetkého, čo má hmotnosť, vrátane látok, ktoré nemôžeme vždy vidieť (napríklad plyny). Ale aj atóm obsahuje malé častice, ktoré tvoria jeho štruktúru. - Atóm sa skladá z troch častí - neutrónov, protónov a elektrónov. Stred atómu sa nazýva jadro. Jadro sa skladá z neutrónov a protónov. Elektróny sú častice, ktoré sa otáčajú okolo vonkajšieho obalu atómu ako planéty okolo Slnka.
- Atóm je veľmi malý. Predstavte si najväčší štadión, aký poznáte. Ak je na štadióne atóm, potom má jadro tohto atómu veľkosť hrášku.
 3 Zistite, aká je atómová štruktúra prvku. Element je látka v prírode, ktorú nemožno rozdeliť na menšie látky. Prvky sa skladajú z atómov.
3 Zistite, aká je atómová štruktúra prvku. Element je látka v prírode, ktorú nemožno rozdeliť na menšie látky. Prvky sa skladajú z atómov. - Atómy v prvku sa nemenia. To znamená, že každý prvok má vo svojej atómovej štruktúre určitý jedinečný počet neutrónov a protónov.
 4 Zistite, ako funguje jadro. Neutróny v jadre majú neutrálny náboj. Protóny majú kladný náboj. Atómové číslo prvku sa rovná počtu protónov v jadre.
4 Zistite, ako funguje jadro. Neutróny v jadre majú neutrálny náboj. Protóny majú kladný náboj. Atómové číslo prvku sa rovná počtu protónov v jadre. - Nie je potrebné počítať počet protónov v jadre. Toto číslo je uvedené v periodickej tabuľke chemických prvkov pre každý prvok.
 5 Spočítajte počet neutrónov v jadre. Môžete použiť číslo z periodickej tabuľky. Atómové číslo prvku je rovnaké ako počet protónov v jadre.
5 Spočítajte počet neutrónov v jadre. Môžete použiť číslo z periodickej tabuľky. Atómové číslo prvku je rovnaké ako počet protónov v jadre. - Atómová hmotnosť je uvedená v spodnej časti štvorca každého prvku pod jeho názvom.
- Nezabudnite, že v jadre atómu sú iba protóny a neutróny. V periodickej tabuľke je uvedený počet protónov a hodnota atómovej hmotnosti.
- Teraz bude všetko ľahké vypočítať. Od atómovej hmotnosti odpočítajte počet protónov a získate počet neutrónov v jadre každého atómu prvku.
 6 Spočítajte počet elektrónov. Nezabudnite, že častice s opačnými nábojmi sa priťahujú. Elektróny sú kladne nabité a otáčajú sa okolo atómu. Počet negatívne nabitých elektrónov, ktoré sú priťahované k jadru, závisí od počtu pozitívne nabitých protónov v jadre.
6 Spočítajte počet elektrónov. Nezabudnite, že častice s opačnými nábojmi sa priťahujú. Elektróny sú kladne nabité a otáčajú sa okolo atómu. Počet negatívne nabitých elektrónov, ktoré sú priťahované k jadru, závisí od počtu pozitívne nabitých protónov v jadre. - Pretože samotný atóm má neutrálny náboj, počet častíc s negatívnym nábojom sa musí rovnať počtu častíc s pozitívnym nábojom. Z tohto dôvodu je počet elektrónov rovný počtu protónov.
 7 Pozrite sa na periodickú tabuľku prvkov. Ak sú pre vás vlastnosti prvkov náročné, preštudujte si všetky dostupné informácie o periodickej tabuľke.
7 Pozrite sa na periodickú tabuľku prvkov. Ak sú pre vás vlastnosti prvkov náročné, preštudujte si všetky dostupné informácie o periodickej tabuľke. - Pochopenie periodickej tabuľky je nevyhnutné pre úspešné zvládnutie skúšky.
- Periodická tabuľka pozostáva iba z prvkov. Každý prvok má abecedný symbol, tento symbol vždy označuje tento prvok. Napríklad Na je vždy sodík. Úplný názov prvku je umiestnený pod symbolom písmena.
- Číslo nad symbolom písmena je atómové číslo. To sa rovná počtu protónov v jadre.
- Číslo pod symbolom písmena je atómová hmotnosť. Nezabudnite, že atómová hmotnosť je súčtom protónov a neutrónov v jadre.
 8 Naučte sa čítať tabuľku. V tabuľke je veľa informácií, od farieb stĺpcov po usporiadanie prvkov zľava doprava a zhora nadol.
8 Naučte sa čítať tabuľku. V tabuľke je veľa informácií, od farieb stĺpcov po usporiadanie prvkov zľava doprava a zhora nadol.
Metóda 3 z 5: Výpočet chemických reakcií
 1 Napíšte rovnicu. Na hodine chémie vás naučia určiť, čo sa stane s prvkami, keď sú kombinované. Na papieri sa to nazýva riešenie rovnice.
1 Napíšte rovnicu. Na hodine chémie vás naučia určiť, čo sa stane s prvkami, keď sú kombinované. Na papieri sa to nazýva riešenie rovnice. - Chemická rovnica pozostáva z látok na ľavej strane, šípky a reakčného produktu. Látky na jednej strane rovnice musia vyvážiť látky na druhej strane.
- Napríklad látka 1 + látka 2 → výrobok 1 + výrobok 2.
- Vezmite cín (Sn) v oxidovanej forme (SnO2) a skombinujte s vodíkom vo forme plynu (H2). SnO2 + H2 → Sn + H2O.
- Táto rovnica musí byť vyvážená, pretože množstvo reagenciálnych látok sa musí rovnať množstvu získaných produktov. Na ľavej strane je viac atómov kyslíka ako na pravej strane.
- Nahraďte dve vodíkové jednotky vľavo a dve molekuly vody vpravo. V konečnej verzii vyzerá vyvážená rovnica takto: SnO2 + 2 H2 → Sn + 2 H2O.
 2 Zamyslite sa nad rovnicami novým spôsobom. Ak je pre vás ťažké vyrovnať rovnice, predstavte si, že je to recept, ktorý však treba upraviť na oboch stranách.
2 Zamyslite sa nad rovnicami novým spôsobom. Ak je pre vás ťažké vyrovnať rovnice, predstavte si, že je to recept, ktorý však treba upraviť na oboch stranách. - V úlohe dostanete ingrediencie na ľavej strane, ale nie je v ňom uvedené, koľko toho musíte vziať. Rovnica tiež hovorí, čo sa stane, ale nehovorí, koľko. Musíte to zistiť.
- Použitím predchádzajúcej rovnice ako príkladu, SnO2 + H2 → Sn + H2O, sa zamyslime nad tým, prečo tento vzorec nebude fungovať. Množstvo Sn je na oboch stranách rovnaké, rovnako ako množstvo H2, ale naľavo sú dve časti kyslíka a napravo je iba jedna.
- Je potrebné zmeniť pravú stranu rovnice tak, aby výsledný produkt obsahoval dve časti H2O. Dvojka pred H2O znamená, že všetky množstvá sa zdvojnásobia. Kyslík je teraz vyvážený, ale dvojka znamená, že vpravo je teraz viac vodíka ako vľavo. Vráťte sa na ľavú stranu a zdvojnásobte vodík umiestnením dvojky pred ňu.
- Teraz je všetko v rovnováhe. Vstupné veličiny sa rovnajú výstupným veličinám.
 3 Pridajte k rovnici ďalšie podrobnosti. Na hodinách chémie sa zoznámite so symbolmi, ktoré označujú fyzikálny stav prvkov: t - tuhá látka, g - plyn, w - kvapalina.
3 Pridajte k rovnici ďalšie podrobnosti. Na hodinách chémie sa zoznámite so symbolmi, ktoré označujú fyzikálny stav prvkov: t - tuhá látka, g - plyn, w - kvapalina.  4 Naučte sa identifikovať zmeny, ku ktorým dochádza počas chemickej reakcie. Chemické reakcie začínajú základnými prvkami alebo zlúčeninami, ktoré reagujú. V dôsledku spojenia sa získa reakčný produkt alebo niekoľko produktov.
4 Naučte sa identifikovať zmeny, ku ktorým dochádza počas chemickej reakcie. Chemické reakcie začínajú základnými prvkami alebo zlúčeninami, ktoré reagujú. V dôsledku spojenia sa získa reakčný produkt alebo niekoľko produktov. - Na úspešné absolvovanie skúšky musíte vedieť, ako vyriešiť rovnice, ktoré obsahujú reaktanty alebo zlúčeninové produkty alebo oboje.
 5 Naučte sa rôzne druhy reakcií. Chemické reakcie môžu prebiehať pod vplyvom rôznych faktorov, a to nielen vtedy, keď sú prvky kombinované.
5 Naučte sa rôzne druhy reakcií. Chemické reakcie môžu prebiehať pod vplyvom rôznych faktorov, a to nielen vtedy, keď sú prvky kombinované. - Najbežnejšími typmi reakcií sú syntéza, analýza, substitúcia, dvojitý rozklad, reakcia medzi kyselinami a zásadami, oxidácia-redukcia, spaľovanie, izomerizácia, hydrolýza.
- V triede je možné študovať rôzne reakcie - všetko závisí od cieľov kurzu.Na univerzite sa stupeň hĺbky materiálu bude líšiť od školských osnov.
 6 Využite všetky dostupné zdroje. Budete musieť pochopiť rozdiel medzi základnými reakciami. Na pochopenie tohto rozdielu použite všetky možné materiály. Nebojte sa klásť otázky.
6 Využite všetky dostupné zdroje. Budete musieť pochopiť rozdiel medzi základnými reakciami. Na pochopenie tohto rozdielu použite všetky možné materiály. Nebojte sa klásť otázky. - Nie je také ľahké pochopiť, čo sa mení počas chemických reakcií. Toto bude jedna z najnáročnejších úloh na hodine chémie.
 7 Zamyslite sa nad reakciami z hľadiska logiky. Skúste sa nenechať zmiasť terminológiou a veci ešte viac skomplikovať. Všetky reakcie sú zamerané na premenu niečoho na niečo iné.
7 Zamyslite sa nad reakciami z hľadiska logiky. Skúste sa nenechať zmiasť terminológiou a veci ešte viac skomplikovať. Všetky reakcie sú zamerané na premenu niečoho na niečo iné. - Napríklad už viete, čo sa stane, ak spojíte dva atómy vodíka a jeden atóm kyslíka - vodu. Ak teda nalejete vodu do hrnca a zapálite ju, niečo sa zmení. Vykonali ste chemickú reakciu. Ak dáte do chladničky vodu, dôjde k reakcii. Zmenili ste niečo, čo zahŕňalo reaktant, ktorým je voda.
- Prejdite všetkými druhmi reakcií, kým všetkému porozumiete. Sústreďte sa na zdroj energie, ktorý spúšťa reakciu a hlavné zmeny, ktoré z reakcie vyplývajú.
- Ak je pre vás ťažké to pochopiť, vytvorte si zoznam nezrozumiteľných nuancií a ukážte ho svojmu učiteľovi, spolužiakom alebo komukoľvek, kto sa v chémii vyzná.
Metóda 4 z 5: Výpočty
 1 Poznať postupnosť základných výpočtov. V chémii sú niekedy potrebné veľmi presné výpočty, ale často stačia základné znalosti z matematiky. Je dôležité pochopiť, v akom poradí sa výpočty vykonávajú.
1 Poznať postupnosť základných výpočtov. V chémii sú niekedy potrebné veľmi presné výpočty, ale často stačia základné znalosti z matematiky. Je dôležité pochopiť, v akom poradí sa výpočty vykonávajú. - Najprv sa v zátvorkách vykonávajú výpočty, potom výpočty v mocninách, potom násobenie alebo delenie a na konci - sčítanie alebo odčítanie.
- V príklade 3 + 2 x 6 = ___ je správna odpoveď 15.
 2 Nebojte sa zaokrúhľovať veľmi dlhé čísla. V chémii sa často zaokrúhľujú, pretože často je odpoveďou na rovnicu číslo s veľkým počtom číslic. Ak sú vo vyhlásení o probléme pokyny na zaokrúhľovanie, vezmite ich do úvahy.
2 Nebojte sa zaokrúhľovať veľmi dlhé čísla. V chémii sa často zaokrúhľujú, pretože často je odpoveďou na rovnicu číslo s veľkým počtom číslic. Ak sú vo vyhlásení o probléme pokyny na zaokrúhľovanie, vezmite ich do úvahy. - Vedieť zaokrúhľovať. Ak je ďalšia číslica 4 alebo menej, zaokrúhľuje sa nadol, ak 5 alebo viac ako 5, zaokrúhľuje sa nahor. Tu je napríklad číslo 6.6666666666666666. Úloha hovorí, že zaokrúhli odpoveď na druhú číslicu za bodkou. Odpoveď je 6,67.
 3 Pochopte, čo je to absolútna hodnota. V chémii majú niektoré čísla absolútny, nie matematický význam. Absolútnou hodnotou sú všetky hodnoty až po číslo od nuly.
3 Pochopte, čo je to absolútna hodnota. V chémii majú niektoré čísla absolútny, nie matematický význam. Absolútnou hodnotou sú všetky hodnoty až po číslo od nuly. - Inými slovami, už nemáte záporné a kladné hodnoty, iba vzdialenosť k nule. Napríklad absolútna hodnota -20 je 20.
 4 Poznáte všetky bežné jednotky merania. Tu je niekoľko príkladov.
4 Poznáte všetky bežné jednotky merania. Tu je niekoľko príkladov. - Množstvo látky sa meria v moloch (mol).
- Teplota sa meria v stupňoch Fahrenheita (° F), Kelvina (° K) alebo Celzia (° C).
- Hmotnosť sa meria v gramoch (g), kilogramoch (kg) alebo miligramoch (mg).
- Objem kvapaliny sa meria v litroch (l) alebo mililitroch (ml).
 5 Precvičte si preklad hodnôt z jedného meracieho systému do druhého. Na skúške sa budete musieť s takýmito prekladmi vysporiadať. Možno budete musieť previesť teplotu z jedného systému na druhý, libry na kilogramy, unce na litre.
5 Precvičte si preklad hodnôt z jedného meracieho systému do druhého. Na skúške sa budete musieť s takýmito prekladmi vysporiadať. Možno budete musieť previesť teplotu z jedného systému na druhý, libry na kilogramy, unce na litre. - Môžete byť požiadaní, aby ste odpovedali v iných jednotkách, ako sú jednotky uvedené vo vyhlásení o probléme. Napríklad v texte problému bude teplota uvedená v stupňoch Celzia a odpoveď bude potrebná v stupňoch Kelvina.
- Teplota chemických reakcií sa obvykle meria v stupňoch Kelvina. Precvičte si prevod Celsia na Fahrenheita alebo Kelvina.
 6 Neponáhľaj sa. Pozorne si prečítajte text problému a naučte sa prevádzať jednotky merania.
6 Neponáhľaj sa. Pozorne si prečítajte text problému a naučte sa prevádzať jednotky merania.  7 Vedieť vypočítať koncentráciu. Zdokonaľte svoje znalosti základnej matematiky výpočtom percent, pomerov a pomerov.
7 Vedieť vypočítať koncentráciu. Zdokonaľte svoje znalosti základnej matematiky výpočtom percent, pomerov a pomerov.  8 Cvičte s nutričnými údajmi na obale. Aby ste zvládli chémiu, musíte byť schopní vypočítať pomery, pomery a percentá v rôznych sekvenciách.Ak je to pre vás náročné, začnite školením v známych merných jednotkách (napríklad na obaloch potravín).
8 Cvičte s nutričnými údajmi na obale. Aby ste zvládli chémiu, musíte byť schopní vypočítať pomery, pomery a percentá v rôznych sekvenciách.Ak je to pre vás náročné, začnite školením v známych merných jednotkách (napríklad na obaloch potravín). - Vezmite si balíček výživových údajov. Uvidíte výpočet kalórií na porciu, odporúčanú dávku za deň ako percento, celkový tuk, percento kalórií z tuku, celkové množstvo sacharidov a rozdelenie podľa typu uhľohydrátov. Naučte sa vypočítať rôzne pomery na základe týchto hodnôt.
- Vypočítajte napríklad množstvo mononenasýtených tukov v celkovom tuku. Previesť na percento. Vypočítajte počet kalórií v balení tak, že poznáte počet porcií a obsah kalórií v každej porcii. Vypočítajte, koľko sodíka je v polovici balenia.
- Pomôže vám to ľahko preložiť chemické hodnoty z jedného systému do druhého, napríklad móly na liter, gramy na mól atď.
 9 Naučte sa používať číslo Avogadra. Toto číslo odráža počet molekúl, atómov alebo častíc v jednom móle. Avogadrova konštanta je 6,022x1023.
9 Naučte sa používať číslo Avogadra. Toto číslo odráža počet molekúl, atómov alebo častíc v jednom móle. Avogadrova konštanta je 6,022x1023. - Napríklad, koľko atómov je v 0,450 móloch Fe? Odpoveď: 0,450 x 6,022x1023.
 10 Myslite na mrkvu. Ak je pre vás ťažké zistiť, ako používať Avogadrovo číslo, skúste počítať mrkvu a nie atómy, molekuly alebo častice. Koľko mrkvy je v tucte? Vieme, že tucet je 12, čo znamená, že v jednom tucte je 12 mrkiev.
10 Myslite na mrkvu. Ak je pre vás ťažké zistiť, ako používať Avogadrovo číslo, skúste počítať mrkvu a nie atómy, molekuly alebo častice. Koľko mrkvy je v tucte? Vieme, že tucet je 12, čo znamená, že v jednom tucte je 12 mrkiev. - Teraz odpovedzme na otázku, koľko mrkvy je v krtku. Namiesto násobenia 12 vynásobíme Avogadrovým číslom. V móle je 6,022 x 1023 mrkiev.
- Avogadrovo číslo sa používa na prevod akejkoľvek hodnoty atómov, molekúl, častíc alebo mrkvy na krtky.
- Ak poznáte počet mólov látky, potom sa hodnota počtu molekúl, atómov alebo častíc bude rovnať tomuto číslu vynásobenému Avogadrovým číslom.
- Pochopenie toho, ako sa častice premieňajú na moly, je dôležitým faktorom pri skúške. Konverzie krtkov sú súčasťou výpočtov pomeru a pomeru. Znamená to množstvo niečoho v krtkoch ako súčasť niečoho iného.
 11 Pochopte molaritu. Zamyslite sa nad počtom mólov látky v kvapaline. Je veľmi dôležité porozumieť tomuto príkladu, pretože hovoríme o molarite, to znamená o podiele látky vyjadrenej v móloch na liter.
11 Pochopte molaritu. Zamyslite sa nad počtom mólov látky v kvapaline. Je veľmi dôležité porozumieť tomuto príkladu, pretože hovoríme o molarite, to znamená o podiele látky vyjadrenej v móloch na liter. - Molarita alebo molárna koncentrácia je termín, ktorý vyjadruje množstvo látky v kvapaline, to znamená množstvo rozpustenej látky v roztoku. Aby ste získali molaritu, musíte rozdeliť móly rozpustenej látky na litre roztoku. Molarita je vyjadrená v móloch na liter.
- Vypočítajte hustotu. Hustota sa často používa v chémii. Hustota je hmotnosť chemikálie na jednotku objemu. Hustota je zvyčajne vyjadrená v gramoch na mililiter alebo v gramoch na centimeter kubický - je to to isté.
 12 Redukujte rovnice na empirický vzorec. To znamená, že odpoveď bude správna, iba ak uvediete všetky hodnoty do ich najjednoduchšej podoby.
12 Redukujte rovnice na empirický vzorec. To znamená, že odpoveď bude správna, iba ak uvediete všetky hodnoty do ich najjednoduchšej podoby. - To neplatí pre molekulárne vzorce, pretože udávajú presné podiely chemických prvkov, ktoré tvoria molekulu.
 13 Zistite, čo je súčasťou molekulárneho vzorca. Molekulový vzorec nie je potrebné uvádzať do najjednoduchšej alebo empirickej podoby, pretože hovorí, z čoho presne je molekula vyrobená.
13 Zistite, čo je súčasťou molekulárneho vzorca. Molekulový vzorec nie je potrebné uvádzať do najjednoduchšej alebo empirickej podoby, pretože hovorí, z čoho presne je molekula vyrobená. - Molekulový vzorec je napísaný pomocou skratiek prvkov a počtu atómov každého prvku v molekule.
- Molekulový vzorec vody je napríklad H20. To znamená, že každá molekula vody obsahuje dva atómy vodíka a jeden atóm kyslíka. Molekulový vzorec acetaminofénu je C8H9NO2. Každá chemická zlúčenina má molekulárny vzorec.
 14 Nezabudnite, že matematika v chémii sa nazýva stechiometria. S týmto pojmom sa stretnete. Toto je opis toho, ako je chémia vyjadrená v matematických vzorcoch. V chemickej matematike alebo stechiometrii je množstvo prvkov a chemických zlúčenín často vyjadrené v móloch, percentách v móloch, móloch na liter alebo moloch na kilogram.
14 Nezabudnite, že matematika v chémii sa nazýva stechiometria. S týmto pojmom sa stretnete. Toto je opis toho, ako je chémia vyjadrená v matematických vzorcoch. V chemickej matematike alebo stechiometrii je množstvo prvkov a chemických zlúčenín často vyjadrené v móloch, percentách v móloch, móloch na liter alebo moloch na kilogram. - Budete musieť previesť gramy na krtky.Atómová hmotnosť jednotky prvku v gramoch sa rovná jednému molu tejto látky. Atómová hmotnosť vápnika je napríklad 40 jednotiek atómovej hmotnosti. 40 gramov vápnika sa teda rovná jednému molu vápnika.
 15 Požiadajte o ďalšie úlohy. Ak sú pre vás rovnice a prevody náročné, porozprávajte sa so svojim učiteľom. Požiadajte o ďalšie úlohy, aby ste na nich mohli pracovať sami, kým nepochopíte podstatu všetkých javov.
15 Požiadajte o ďalšie úlohy. Ak sú pre vás rovnice a prevody náročné, porozprávajte sa so svojim učiteľom. Požiadajte o ďalšie úlohy, aby ste na nich mohli pracovať sami, kým nepochopíte podstatu všetkých javov.
Metóda 5 z 5: Jazyk chémie
 1 Naučte sa porozumieť Lewisovým grafom. Lewisove grafy sa niekedy nazývajú bodové grafy. Ide o jednoduché diagramy, v ktorých bodky predstavujú voľné a viazané elektróny vo vonkajšom obale atómu.
1 Naučte sa porozumieť Lewisovým grafom. Lewisove grafy sa niekedy nazývajú bodové grafy. Ide o jednoduché diagramy, v ktorých bodky predstavujú voľné a viazané elektróny vo vonkajšom obale atómu. - Takýto systém vám umožňuje nakresliť jednoduché diagramy, ktoré by odrážali väzby medzi prvkami v atóme alebo molekule, napríklad kovalentné.
 2 Zistite, čo je pravidlo oktetu. Pri konštrukcii Lewisových diagramov sa používa oktetové pravidlo, ktoré hovorí, že atóm sa stáva stabilným, keď má vo svojom vonkajšom obale prístup k ôsmim elektrónom. Vodík je výnimkou - považuje sa za stabilný, ak sú vo vonkajšom obale dva elektróny.
2 Zistite, čo je pravidlo oktetu. Pri konštrukcii Lewisových diagramov sa používa oktetové pravidlo, ktoré hovorí, že atóm sa stáva stabilným, keď má vo svojom vonkajšom obale prístup k ôsmim elektrónom. Vodík je výnimkou - považuje sa za stabilný, ak sú vo vonkajšom obale dva elektróny.  3 Nakreslite Lewisov diagram. Symbol písmena prvku je obklopený bodkami a je Lewisovým diagramom. Predstavte si, že diagram je rám filmu. Elektróny sa netočia okolo vonkajšieho plášťa prvkov - odrážajú sa v určitom časovom období.
3 Nakreslite Lewisov diagram. Symbol písmena prvku je obklopený bodkami a je Lewisovým diagramom. Predstavte si, že diagram je rám filmu. Elektróny sa netočia okolo vonkajšieho plášťa prvkov - odrážajú sa v určitom časovom období. - Diagram zobrazuje stacionárnu hmotnosť elektrónov, kde sú spojené s iným prvkom, a informácie o väzbe (napríklad či sú väzby zdvojené a zdieľané medzi niekoľkými elektrónmi).
- Zamyslite sa nad pravidlom oktetu a predstavte si symbol prvku - napríklad C (uhlík). Nakreslite dve bodky, každý na východ, západ, sever a juh symbolu. Teraz nakreslite symbol H (atóm vodíka) na každú stranu každého z bodov. Diagram ukazuje, že každý atóm uhlíka je obklopený štyrmi atómami vodíka. Ich elektróny sú kovalentne viazané, to znamená, že pre atómy uhlíka a vodíka je jeden z elektrónov viazaný na elektrón druhého prvku.
- Molekulový vzorec takejto zlúčeniny je CH4. Je to metánový plyn.
 4 Pochopte, ako elektróny viažu prvky. Lewisove diagramy predstavujú chemické väzby v jednoduchej forme.
4 Pochopte, ako elektróny viažu prvky. Lewisove diagramy predstavujú chemické väzby v jednoduchej forme. - Ak nerozumiete, ako sú prvky prepojené a čo predstavujú Lewisove diagramy, prediskutujte túto tému so svojim učiteľom a spolužiakmi.
 5 Zistite, ako sa spojenia nazývajú. Chémia má svoje vlastné terminologické pravidlá. Typy reakcií, strata alebo zisk elektrónov vo vonkajšom plášti a stabilita alebo nestabilita prvkov sú súčasťou terminológie chémie.
5 Zistite, ako sa spojenia nazývajú. Chémia má svoje vlastné terminologické pravidlá. Typy reakcií, strata alebo zisk elektrónov vo vonkajšom plášti a stabilita alebo nestabilita prvkov sú súčasťou terminológie chémie.  6 Ber to vážne. Mnoho chemických kurzov má na to samostatné kapitoly. Neznalosť terminológie často znamená neúspech na skúške.
6 Ber to vážne. Mnoho chemických kurzov má na to samostatné kapitoly. Neznalosť terminológie často znamená neúspech na skúške. - Ak je to možné, preštudujte si terminológiu pred vyučovaním. Špeciálnu literatúru si môžete kúpiť v bežnom kníhkupectve alebo na internete.
 7 Zistite, čo znamenajú čísla nad a pod čiarou. Toto je veľmi dôležitá súčasť výučby chémie.
7 Zistite, čo znamenajú čísla nad a pod čiarou. Toto je veľmi dôležitá súčasť výučby chémie. - Čísla nad čiarou je možné vidieť v periodickej tabuľke prvkov. Predstavujú celkový náboj prvku alebo chemickej zlúčeniny. Preskúmajte periodickú tabuľku a prvky vo zvislých riadkoch, ktoré majú rovnaké čísla indexov.
- Čísla v spodnej časti riadku slúžia na opis množstva každého prvku, ktorý vstupuje do zlúčeniny. Ako bolo uvedené vyššie, 2 vo vzorci H20 naznačuje, že v molekule vody sú dva atómy vodíka.
 8 Pochopte, ako atómy navzájom reagujú. V terminológii existujú špeciálne pravidlá, ktoré by sa mali dodržiavať pri pomenovaní produktov určitých typov reakcií.
8 Pochopte, ako atómy navzájom reagujú. V terminológii existujú špeciálne pravidlá, ktoré by sa mali dodržiavať pri pomenovaní produktov určitých typov reakcií. - Jednou z reakcií je oxidácia-redukcia. Počas reakcie dochádza buď k získavaniu alebo strate elektrónov.
- Elektróny sa počas oxidácie strácajú a získavajú počas redukcie.
 9 Čísla v spodnej časti riadku môžu naznačovať vzorec stabilného náboja zlúčeniny. Vedci používajú tieto čísla na opis konečného molekulárneho vzorca zlúčeniny, ktorý tiež označuje stabilnú zlúčeninu s neutrálnym nábojom.
9 Čísla v spodnej časti riadku môžu naznačovať vzorec stabilného náboja zlúčeniny. Vedci používajú tieto čísla na opis konečného molekulárneho vzorca zlúčeniny, ktorý tiež označuje stabilnú zlúčeninu s neutrálnym nábojom. - Na získanie neutrálneho náboja musí byť kladne nabitý ión, nazývaný katión, vyvážený rovnakým nábojom z negatívneho iónu, aniónu. Tieto poplatky sú uvedené v spodnej časti riadku.
- Napríklad v ióne horčíka je +2 náboj katiónu a v dusíkovom ióne je -3 náboj aniónu. +2 a -3 sú uvedené v spodnej časti riadku. Aby ste získali neutrálny náboj, na každé 2 jednotky dusíka musíte použiť 3 atómy horčíka.
- Vo vzorci je to zapísané nasledovne: Mg3N2
 10 Naučte sa rozpoznávať anióny a katióny podľa ich polohy v periodickej tabuľke prvkov. Prvky v tabuľke, ktoré sú v prvom stĺpci, sú alkalické kovy a majú +1 katiónový náboj. Napríklad Na + a Li +.
10 Naučte sa rozpoznávať anióny a katióny podľa ich polohy v periodickej tabuľke prvkov. Prvky v tabuľke, ktoré sú v prvom stĺpci, sú alkalické kovy a majú +1 katiónový náboj. Napríklad Na + a Li +. - Kovy alkalických zemín v druhom stĺpci majú katiónový náboj 2+, ako je Mg2 + a Ba2 +.
- Prvky v siedmom stĺpci sa nazývajú halogény a majú -1 náboj aniónov, ako sú Cl- a I-.
 11 Naučte sa rozpoznávať bežné anióny a katióny. Na úspešné absolvovanie testu sa naučte všetku terminológiu spojenú so skupinami položiek. Tieto čísla v spodnej časti riadku sa nemenia.
11 Naučte sa rozpoznávať bežné anióny a katióny. Na úspešné absolvovanie testu sa naučte všetku terminológiu spojenú so skupinami položiek. Tieto čísla v spodnej časti riadku sa nemenia. - Inými slovami, horčík je vždy Mg s nábojom +2 katiónu.
 12 Snažte sa nenechať sa zmiasť informáciami. Budú cez vás prechádzať informácie o rôznych druhoch chemických reakcií, o výmene elektrónov, o zmene náboja prvku alebo jeho zložky a to všetko bude ťažké asimilovať.
12 Snažte sa nenechať sa zmiasť informáciami. Budú cez vás prechádzať informácie o rôznych druhoch chemických reakcií, o výmene elektrónov, o zmene náboja prvku alebo jeho zložky a to všetko bude ťažké asimilovať. - Rozložte ťažké témy na kúsky. Ak napríklad nerozumiete oxidačnej reakcii alebo princípu kombinovania prvkov s pozitívnymi a negatívnymi nábojmi, začnite hovoriť všetky informácie, ktoré poznáte, a pochopíte, že ste už veľa dokázali pochopiť a zapamätať si.
 13 Rozhovor s učiteľom pravidelne. Vytvorte si zoznam ťažkých tém a požiadajte svojho učiteľa, aby vám pomohol. To vám dá šancu internalizovať materiál predtým, ako skupina prejde na ďalšiu tému, čo vás bude ďalej miasť.
13 Rozhovor s učiteľom pravidelne. Vytvorte si zoznam ťažkých tém a požiadajte svojho učiteľa, aby vám pomohol. To vám dá šancu internalizovať materiál predtým, ako skupina prejde na ďalšiu tému, čo vás bude ďalej miasť.  14 Predstavte si, že chémia je ako učiť sa nový jazyk. Je dôležité pochopiť, že poplatky za písanie, počet atómov v molekule a väzba medzi molekulami sú súčasťou chemického jazyka. To všetko odráža to, čo sa deje v prírode na papieri.
14 Predstavte si, že chémia je ako učiť sa nový jazyk. Je dôležité pochopiť, že poplatky za písanie, počet atómov v molekule a väzba medzi molekulami sú súčasťou chemického jazyka. To všetko odráža to, čo sa deje v prírode na papieri. - Bolo by oveľa jednoduchšie tomu všetkému porozumieť, keby všetky procesy bolo možné sledovať naživo. Je pre vás dôležité nielen porozumieť zásadám procesov, ale aj jazyku, ktorý sa používa na zaznamenávanie týchto informácií.
- Ak vám je štúdium chémie ťažké, nezabudnite, že ste sami a nevzdávate sa. Porozprávajte sa so svojim inštruktorom, skupinou alebo s kýmkoľvek, kto sa v danej téme dobre vyzná. Toto všetko sa dá naučiť, ale správnejšie by bolo, keby vám niekto materiál vysvetlil, aby ste všetkému rozumeli.
Tipy
- Nezabudnite na odpočinok. Prestávka v štúdiu vám umožní vrátiť sa do školy s čerstvou mysľou.
- Vyspať sa v predvečer skúšky. Spiaci človek má lepšiu pamäť a koncentráciu.
- Prečítajte si, čo už viete. Chémia je veda postavená na štúdiu jedného javu a rozšírení znalostí. Je dôležité mať v pamäti všetko, čo ste sa naučili, aby vás otázka na skúške neprekvapila.
- Pripravte sa na hodinu. Prečítajte si všetky materiály a urobte si domácu úlohu. Ak vám niečo chýba, budete stále viac zaostávať.
- Prideliť čas. Venujte väčšiu pozornosť chémii, ak vám tento predmet nie je dobrý, ale nevenujte sa mu všetok čas, pretože existujú aj iné predmety.