Autor:
Lewis Jackson
Dátum Stvorenia:
12 Smieť 2021
Dátum Aktualizácie:
1 V Júli 2024
Obsah
Elektrónová konfigurácia atómu je rad čísel predstavujúcich elektrónové orbitaly. Electron Obitans sú priestorové oblasti rôznych tvarov obklopujúcich jadro atómu, v ktorých sú usporiadané elektróny usporiadane. Vďaka konfigurácii elektrónov môžete rýchlo určiť, koľko elektrónových orbitálov je v atóme, a počet elektrónov v každej obežnej dráhe. Keď pochopíte základné princípy konfigurácie elektrónov, budete schopní napísať svoju vlastnú konfiguráciu elektrónov a budete môcť spoľahlivo robiť chemické testy.
Kroky
Metóda 1 z 2: Určte počet elektrónov pomocou chemickej periodickej tabuľky
Nájdite atómové číslo atómu. Každý atóm má s ním spojený konkrétny počet elektrónov. Vyhľadajte prvok v periodickej tabuľke. Atómové číslo je kladné celé číslo začínajúce na 1 (pre vodík) a zvyšujúce sa o 1 pre každý atóm potom. Atómové číslo je počet protónov atómu - je to teda aj počet elektrónov atómu v základnom stave.
- Určte náboj atómu. Elektricky neutrálny atóm má správny počet elektrónov, ako je uvedené v periodickej tabuľke. Atóm s nábojom však bude mať viac alebo menej elektrónov na základe veľkosti náboja. Ak pracujete s atómami s nábojom, sčítajte alebo odčítajte zodpovedajúci počet elektrónov: pridajte jeden elektrón pre každý záporný náboj a odčítajte jeden elektrón pre každý kladný náboj.
- Napríklad atóm sodíka s nábojom +1 bude mať jeden elektrón odstránený zo základného atómového čísla 11. Preto bude mať atóm sodíka celkom 10 elektrónov.
- Zapamätajte si základný orbitálny zoznam. Keď atóm prijme elektróny, budú tieto elektróny usporiadané do orbitálov v konkrétnom poradí. Keď elektróny vyplnia orbitaly, počet elektrónov v každej obežnej dráhe je párny. Máme nasledujúce orbitály:
- Obitan s (ľubovoľné číslo so znakom „s“ v konfigurácii elektrónov) má iba jednu orbitálnu dráhu a nasleduje Princíp Okrem PaulihoKaždý orbitál obsahuje maximálne 2 elektróny, takže každý s orbitál obsahuje iba 2 elektróny.
- Obitan p má 3 orbitaly, takže pojme až 6 elektrónov.
- Obitan d má 5 orbitálov, takže pojme až 10 elektrónov.
- Obitan f má 7 orbitálov, takže môže obsahovať až 14 elektrónov. Poradie orbitálov si zapamätajte podľa nasledujúcej chytľavej vety:
Sna Pagresívny Duh FDobre Gotupený HOjoj ÍKJa prídem.
V prípade atómov s väčším počtom elektrónov sa orbitály naďalej píšu abecedne za písmenom k, vynechajúc použité znaky.
- Pochopte konfiguráciu elektrónov. Elektrónové konfigurácie sú napísané tak, aby jasne ukazovali počet elektrónov v atóme, ako aj počet elektrónov v každej obežnej dráhe. Každá obežná dráha je napísaná v určitom poradí, pričom počet elektrónov v každej obežnej dráhe je napísaný nad pravou časťou jeho názvu. Nakoniec je konfigurácia elektrónov sekvencia pozostávajúca z mien orbitalov a počtu elektrónov napísaných vyššie napravo od nich.
- Nasledujúci príklad je jednoduchá konfigurácia elektrónov: 1 s 2 s 2 str. Táto konfigurácia ukazuje, že na obežnej dráhe 1 s sú dva elektróny, na obežnej dráhe 2 s dva elektróny a na obežnej dráhe 2 p šesť elektrónov. 2 + 2 + 6 = 10 elektrónov (celkom). Táto elektrónová konfigurácia je pre elektricky neutrálny neónový atóm (atómové číslo neónu je 10).
- Zapamätajte si poradie orbitálov. Všimnite si, že orbitaly sú očíslované podľa elektrónovej triedy, ale sú energeticky usporiadané. Napríklad orbitál 4s je nasýtený nižšou energiou (alebo trvácnejšie) ako nasýtený alebo nenasýtený 3d orbitál, preto sa najskôr napíše podtrieda 4s. Keď poznáte poradie orbitálov, môžete do nich usporiadať elektróny podľa počtu elektrónov v atóme. Poradie umiestňovania elektrónov na orbitály je takéto: 1 s, 2 s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p, 8s.
- Elektrónová konfigurácia atómu s každým elektrónom naplneným orbitálom je napísaná takto: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d7p
- Upozorňujeme, že ak sú všetky vrstvy naplnené, vyššie uvedená konfigurácia elektrónov je konfigurácia Og (Oganesson), 118, čo je atóm s najvyšším počtom v periodickej tabuľke - obsahujúci všetky v súčasnosti známe elektrónové vrstvy pre s elektricky neutrálnym atómom.
- Zoraďte elektróny na orbitaly podľa počtu elektrónov v atóme. Napríklad, ak chcete napísať elektrónovú konfiguráciu elektricky neutrálneho atómu vápnika, najskôr musíte nájsť jeho atómové číslo v periodickej tabuľke. Atómové číslo vápnika je 20, takže konfiguráciu atómu s 20 elektrónmi napíšeme v poradí vyššie.
- Dajte svoje elektróny na orbitály v poradí vyššie, kým nedosiahnete 20 elektrónov. Obitan 1s dostane dva elektróny, 2s získa dva, 2p získa šesť, 3s získa dva, 3p získa šesť a 4s dva (2 + 2 + 6 +2 +6 + 2 = 20). Z tohto dôvodu je elektrónová konfigurácia vápnika: 1s 2s 2p 3s 3p 4s.
- Poznámka: Úroveň energie sa mení so zvyšovaním elektrónovej vrstvy. Napríklad, keď píšete na 4. energetickú úroveň, najskôr sa napíše podtrieda 4s, neskôr do 3d. Po napísaní štvrtej úrovne energie prejdete na piatu úroveň a znovu spustíte poradie vrstvenia. To sa deje až po 3. energetickej úrovni.
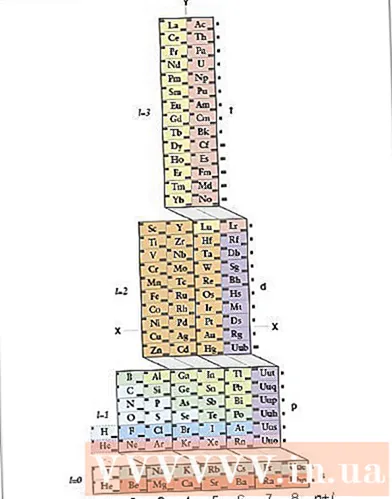
- Periodickú tabuľku použite ako vizuálnu skratku. Možno ste si všimli, že tvar periodickej tabuľky zodpovedá rádu orbitálov v elektrónovej konfigurácii. Napríklad atómy v druhom ľavom stĺpci vždy končia na „s“, atómy na pravej strane strednej časti vždy končia na „d“ atď. Na zápis štruktúr používajte periodickú tabuľku. obrázok - poradie, v ktorom sú elektróny umiestnené na orbitáloch, bude zodpovedať pozíciám uvedeným v periodickej tabuľke. Pozri nižšie:
- Dva stĺpce úplne vľavo sú atómy, ktorých elektrónová konfigurácia končí na orbitále, pravá časť periodickej tabuľky sú atómy s elektrónovou konfiguráciou končícou na orbitáli p, stredná časť sú atómy, ktoré končia na orbitále. d a nižšie sú atómy, ktoré končia vo f orbitále.
- Napríklad pri zápise elektrónovej konfigurácie prvku chlór urobte nasledujúci argument: Tento atóm je v treťom riadku (alebo „perióde“) periodickej tabuľky. Nachádza sa tiež v piatom stĺpci p orbitálneho bloku periodickej tabuľky. Takže elektrónová konfigurácia skončí ... 3p.
- Opatrne! Orbitálne triedy d a f v periodickej tabuľke zodpovedajú energetickým hladinám odlišným od ich obdobia. Napríklad prvý rad orbitálneho bloku d zodpovedá 3d orbitálu, aj keď je v perióde 4, zatiaľ čo prvý rad orbitálu zodpovedá orbitálu 4f, aj keď je v perióde 6.
- Naučte sa, ako písať skladateľné konfigurácie elektrónov. Atómy pozdĺž pravého okraja periodickej tabuľky sa nazývajú vzácny plyn. Tieto prvky sú chemicky veľmi inertné. Ak chcete skrátiť konfiguráciu dlhých elektrónov, napíšte do hranatých zátvoriek chemický symbol pre najbližší vzácny plyn, ktorý má menej elektrónov ako má atóm, a potom pokračujte v písaní elektrónových konfigurácií ďalších orbitalov. . Pozri nižšie:
- Aby ste pochopili tento koncept, napíšte konfiguráciu zrúteného elektrónu na príklade. Predpokladajme, že musíme napísať elektrónovú konfiguráciu na redukciu zinku (atómové číslo 30) cez konfiguráciu vzácnych plynov. Plná elektrónová konfigurácia zinku je: 1s 2s 2p 3s 3p 4s 3d. Upozorňujeme však, že 1s 2s 2p 3s 3p je konfigurácia pre vzácny agonický plyn. Stačí nahradiť túto časť zápisu elektrónov zinku agonickým chemickým symbolom v hranatých zátvorkách ().
- Preto je elektrónová konfigurácia zinku kompaktná 4 s 3d.
Metóda 2 z 2: Použitie periodickej tabuľky ADOMAH

Preskúmajte periodickú tabuľku ADOMAH. Tento spôsob zápisu konfigurácie elektrónov nevyžaduje memorovanie. Táto metóda však vyžaduje preskupenú periodickú tabuľku, pretože v pravidelnej periodickej tabuľke počet cyklov od štvrtého radu nezodpovedá elektrónovej vrstve. Nájdite periodickú tabuľku ADOMAH, špeciálnu chemickú periodickú tabuľku, ktorú navrhol vedec Valery Tsimmerman. Túto periodickú tabuľku nájdete na internete.- V periodickej tabuľke ADOMAH sú horizontálne riadky skupiny prvkov, ako sú halogény, inertné plyny, alkalické kovy, kovy alkalických zemín atď. Vertikálne stĺpce zodpovedajú elektrónovej vrstve a nazývajú sa „priečky“ (diagonálne križovatky). bloky s, p, d a f) zodpovedajú obdobiu.
- Hélium je usporiadané vedľa vodíka, pretože obidve majú jedinečný orbitál 1 s. Periodické bloky (s, p, d a f) sú zobrazené na pravej strane a počet elektrónových vrstiev je uvedený na základni. Názvy prvkov sú napísané v obdĺžniku s číslami 1 až 120. Tieto čísla sú zvyčajné atómové čísla predstavujúce celkový počet elektrónov v elektricky neutrálnom atóme.
- Nájdite prvky v periodickej tabuľke ADOMAH. Ak chcete napísať elektrónovú konfiguráciu prvku, nájdite jeho symbol na periodickej tabuľke ADOMAH a prečiarknite všetky prvky s vyššími atómovými číslami. Napríklad ak chcete napísať elektrónovú konfiguráciu eribi (68), prečiarknite prvky 69 až 120.
- Všimnite si čísla 1 až 8 na základni periodickej tabuľky. Toto je počet elektrónových vrstiev alebo stĺpcov. Nedávajte pozor na stĺpce, ktoré majú iba prečiarknuté prvky.V prípade eribi sú zvyšné stĺpce 1, 2, 3, 4, 5 a 6.
- Na zapísanie konfigurácie spočítajte počet orbitálov do polohy atómu. Pozrite sa na symbol bloku zobrazený napravo od periodickej tabuľky (s, p, d a f) a pozrite sa na počet stĺpcov zobrazených na spodnej časti tabuľky, bez ohľadu na diagonálne čiary medzi blokmi, rozdeľte stĺpce na bloky stĺpcov a napíšte sú v poradí zdola nahor. Ignorujte bloky stĺpcov obsahujúce iba prečiarknuté prvky. Zapisujte bloky stĺpcov počínajúc číslom stĺpca a potom symbolom bloku, napríklad takto: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s (v prípade eribi).
- Poznámka: Vyššie uvedená konfigurácia elektrónov pre Er je zapísaná vzostupne podľa počtu elektrónových vrstiev. Túto konfiguráciu je možné zapísať aj v poradí umiestňovania elektrónov na orbitály. Pri písaní blokov stĺpcov postupujte podľa krokov zhora nadol namiesto stĺpcov: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f.
- Spočítajte počet elektrónov na obežnú dráhu. Spočítajte počet elektrónov, ktoré nie sú vyčiarknuté v každom stĺpcovom bloku, priraďte jeden elektrón na prvok a pre každý blok-stĺpec napíšte počet elektrónov vedľa symbolu bloku: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s. V tomto príklade je to elektrónová konfigurácia eribi.
- Rozpoznávajte neobvyklé konfigurácie elektrónov. Existuje osemnásť bežných výnimiek z elektrónovej konfigurácie atómov v stave s najnižšou energiou, známeho tiež ako základný stav. V porovnaní so všeobecným pravidlom sa líšia iba od posledných dvoch až troch polôh elektrónov. V tomto prípade skutočná konfigurácia elektrónov spôsobuje, že elektróny majú nižší energetický stav ako štandardná konfigurácia atómu. Nezvyčajné atómy sú:
- Cr (..., 3d5, 4s1); Cu (..., 3d10, 4s1); Pozn (..., 4d4, 5s1); Mo (..., 4d5, 5s1); Ru (..., 4d7, 5s1); Rh (..., 4d8, 5s1); Pd (..., 4d10, 5s0); Ag (..., 4d10, 5s1); La (..., 5d1, 6s2); Ce (..., 4f1, 5d1, 6s2); Gd (..., 4f7, 5d1, 6s2); Au (..., 5d10, 6s1); Ac (..., 6d1, 7s2); Th (..., 6d2, 7s2); Pa (..., 5f2, 6d1, 7s2); U (..., 5f3, 6d1, 7s2); Np (..., 5f4, 6d1, 7s2) a Cm (..., 5f7, 6d1, 7s2).
Rada
- Keď je atómom ión, znamená to, že počet protónov sa nerovná počtu elektrónov. Náboj atómu sa potom zobrazuje v (zvyčajne) pravom hornom rohu symbolu prvku. Preto bude mať atóm antimónu s nábojom +2 elektrónovú konfiguráciu 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p. Upozorňujeme, že 5p sa zmení na 5p. Buďte opatrní, keď konfigurácia elektricky neutrálneho atómu končí na iných orbitáloch ako s a p. S odstránenými elektrónmi môžete brať elektróny iba z valenčných orbitálov (s a p orbitaly). Takže ak konfigurácia končí na 4 s 3d a atóm má náboj +2, konfigurácia sa zmení na 4 s 3d. Vidíme 3dkonštantný, ale odstránia sa iba elektróny na orbitále.
- Všetky atómy majú sklon k návratu do stabilného stavu a najstabilnejšia elektrónová konfigurácia bude mať dostatok s a p orbitálov (s2 a p6). Tieto vzácne plyny majú túto elektrónovú konfiguráciu, a preto sa zriedka zúčastňujú reakcií a nachádzajú sa na pravej strane periodickej tabuľky. Takže ak konfigurácia končí na 3p, na stabilizáciu stačí pridať ďalšie dva elektróny (rozdanie šiestich elektrónov vrátane orbitálnych s by vyžadovalo viac energie, takže rozdanie štyroch elektrónov by bolo jednoduché. jednoduchšie). Ak konfigurácia končí na 4d, na dosiahnutie stabilného stavu stačí rozdať tri elektróny. Rovnako aj nové podtriedy, ktoré prijímajú polovicu elektrónov (s1, p3, d5 ..), sú stabilnejšie, napr. P4 alebo p2, ale s2 a p6 budú ešte stabilnejšie.
- Môžete tiež použiť konfiguráciu valenčných elektrónov na napísanie elektrónovej konfigurácie prvku, ktorý je posledným orbitálom s a p. Preto je valenčná konfigurácia atómu antimónu pre antimón 5s 5p.
- To sa nepáči aniónom, pretože sú oveľa odolnejšie. Preskočte vyššie uvedené dva kroky tohto článku a postupujte rovnakým spôsobom podľa toho, kde začínate a koľko alebo menej elektrónov máte.
- Ak chcete zistiť atómové číslo z jeho elektrónovej konfigurácie, pridajte všetky čísla, ktoré nasledujú za písmenami (s, p, d a f). Toto je správne, iba ak ide o neutrálny atóm, ak ide o ión, nemôžete použiť túto metódu. Namiesto toho musíte pridať alebo odčítať počet elektrónov, ktoré prijmete alebo rozdáte.
- Číslo za písmenom musí byť napísané v pravom hornom rohu, pri teste nesmiete písať nesprávne.
- Existujú dva rôzne spôsoby zápisu elektrónových konfigurácií. Môžete písať vo vzostupnom poradí elektrónovej vrstvy alebo v poradí, v akom sú elektróny umiestnené na orbitály, ako je to znázornené pre atóm eribi.
- Existujú prípady, keď je potrebné elektrón „posunúť nahor“. To je prípad, keď na obežnej dráhe chýba iba jeden elektrón, aby mal polovicu alebo všetky elektróny, potom musíte vziať elektrón z najbližšieho s alebo p obežného dráhy, aby ste ho preniesli na obežnú dráhu, ktorá tento elektrón potrebuje.
- Nemôžeme povedať, že „stabilita energetickej frakcie“ podtriedy prijíma polovicu elektrónov. To je príliš zjednodušenie. Dôvodom stabilnej energetickej úrovne novej podtriedy prijímajúcej „polovičný počet elektrónov“ je to, že každý orbitál má iba jeden jediný elektrón, takže odpudzovanie elektrónov a elektrónov je minimalizované.