Autor:
Eugene Taylor
Dátum Stvorenia:
12 August 2021
Dátum Aktualizácie:
22 V Júni 2024
Obsah
- Na krok
- Časť 1 z 2: Normálna elektrónová konfigurácia prvku
- Časť 2 z 2: Konfigurácia elektrónov vzácneho plynu
- Varovania
Vypísanie konfigurácie elektrónov pre prvok je dobrý spôsob, ako sa pozrieť na distribúciu elektrónov v atóme. V závislosti od prvku môže byť vzorec veľmi dlhý. Vedci preto vyvinuli skratkovú notáciu, ktorá pomocou vzácneho plynu predstavuje elektróny, ktoré nie sú valenčné elektróny. To zjednodušuje konfiguráciu elektrónov a uľahčuje pochopenie chemických vlastností prvku.
Na krok
Časť 1 z 2: Normálna elektrónová konfigurácia prvku
 Určte počet elektrónov prítomných v prvku. Atómové číslo prvku vám povie počet protónov, ktoré má. Pretože prvky v neutrálnom stave majú rovnaký počet protónov a elektrónov, môžete tiež použiť atómové číslo ako počet elektrónov, ktoré daný prvok má. Atómové číslo, ktoré nájdete v periodickej tabuľke, je číslo priamo nad symbolom prvku.
Určte počet elektrónov prítomných v prvku. Atómové číslo prvku vám povie počet protónov, ktoré má. Pretože prvky v neutrálnom stave majú rovnaký počet protónov a elektrónov, môžete tiež použiť atómové číslo ako počet elektrónov, ktoré daný prvok má. Atómové číslo, ktoré nájdete v periodickej tabuľke, je číslo priamo nad symbolom prvku. - Napríklad symbol pre sodík je Na. Atómové číslo Na je 11.
 Znalosti o elektrónových škrupinách a energetických hladinách. Prvý elektrónový obal má iba energetickú hladinu s, druhý elektrónový obal má energetickú hladinu s aj p. Tretí elektrónový obal má energetickú hladinu s, p a d. Štvrtý elektrónový obal má energetickú hladinu s, p, d a f. Existujú viac ako štyri elektrónové škrupiny, ale na stredoškolskej chémii sa spravidla stretnete iba s prvými štyrmi.
Znalosti o elektrónových škrupinách a energetických hladinách. Prvý elektrónový obal má iba energetickú hladinu s, druhý elektrónový obal má energetickú hladinu s aj p. Tretí elektrónový obal má energetickú hladinu s, p a d. Štvrtý elektrónový obal má energetickú hladinu s, p, d a f. Existujú viac ako štyri elektrónové škrupiny, ale na stredoškolskej chémii sa spravidla stretnete iba s prvými štyrmi. - Každá energetická úroveň môže obsahovať až 2 elektróny.
- Každá energetická hladina p môže obsahovať až 6 elektrónov.
- Každá energetická hladina d môže obsahovať až 10 elektrónov.
- Každá úroveň energie f môže obsahovať až 14 elektrónov.
 Naučte sa pravidlá elektronového plnenia. Podľa Aufbauovho princípu musíte pridať elektróny na najnižšiu úroveň energie predtým, ako sa dá elektrón pridať na vyššiu hladinu energie. Každá energetická úroveň môže mať viac suborbitálov, ale každý suborbitál môže obsahovať naraz až dva elektróny. Energetická úroveň s má jeden suborbitál, p má 3 suborbitály, d má 5 suborbitálov a f má 7 suborbitálov.
Naučte sa pravidlá elektronového plnenia. Podľa Aufbauovho princípu musíte pridať elektróny na najnižšiu úroveň energie predtým, ako sa dá elektrón pridať na vyššiu hladinu energie. Každá energetická úroveň môže mať viac suborbitálov, ale každý suborbitál môže obsahovať naraz až dva elektróny. Energetická úroveň s má jeden suborbitál, p má 3 suborbitály, d má 5 suborbitálov a f má 7 suborbitálov. - Energetická úroveň d má o niečo vyššiu energiu ako energetická hladina nižšieho elektrónového plášťa, takže vyššia energetická hladina s pravdepodobnejšie zaplní ako nižšia energetická hladina d. Pre zápis konfigurácie elektrónov to znamená, že to bude vyzerať takto: 1s2s2p3s3p4s3d.
 Na zápis konfigurácií elektrónov použite diagonálny konfiguračný graf. Najjednoduchší spôsob, ako si zapamätať, ako sa elektróny plnia, je použitie konfiguračnej schémy. Do toho si zapíšete každú škrupinu a energetické úrovne. Nakreslite diagonálne čiary z pravého horného rohu do ľavej dolnej časti každého riadku. Schéma konfigurácie je nasledovná:
Na zápis konfigurácií elektrónov použite diagonálny konfiguračný graf. Najjednoduchší spôsob, ako si zapamätať, ako sa elektróny plnia, je použitie konfiguračnej schémy. Do toho si zapíšete každú škrupinu a energetické úrovne. Nakreslite diagonálne čiary z pravého horného rohu do ľavej dolnej časti každého riadku. Schéma konfigurácie je nasledovná: - 1 s
2s 2p
3s 3p 3d
4s 4p 4d 4f
5s 5p 5d 5f
6s 6p 6d
7s 7p - Napríklad: Elektrónová konfigurácia sodíka (11 elektrónov) je: 1s2s2p3s.
- 1 s
 Určite poslednú obežnú dráhu každej konfigurácie. Pri pohľade na periodickú tabuľku môžete určiť, aká bude posledná podškrupina a posledná energetická úroveň konfigurácie elektrónov. Najskôr určte, do ktorého bloku prvok spadá (s, p, d alebo f). Potom spočítajte, v ktorom riadku sa prvok nachádza. Na záver spočítajte, v ktorom stĺpci sa prvok nachádza.
Určite poslednú obežnú dráhu každej konfigurácie. Pri pohľade na periodickú tabuľku môžete určiť, aká bude posledná podškrupina a posledná energetická úroveň konfigurácie elektrónov. Najskôr určte, do ktorého bloku prvok spadá (s, p, d alebo f). Potom spočítajte, v ktorom riadku sa prvok nachádza. Na záver spočítajte, v ktorom stĺpci sa prvok nachádza. - Napríklad sodík je v s bloku, takže posledná dráha jeho elektrónovej konfigurácie je s. Nachádza sa v treťom riadku a prvom stĺpci, takže posledná orbitálna dráha je 3 s. Toto je dobrý spôsob, ako skontrolovať svoju konečnú odpoveď.
- Pre d orbitál je pravidlo trochu iné. Prvý riadok prvkov d-bloku sa začína v štvrtom riadku, musíte však od čísla riadku odpočítať 1, pretože úrovne s majú nižšiu energiu ako úrovne d. Napríklad: vanád končí 3d.
- Ďalším spôsobom, ako skontrolovať svoju prácu, je spočítať všetky horné indexy. Musia sa rovnať počtu elektrónov v prvku. Ak máte príliš málo alebo príliš veľa elektrónov, mali by ste svoju prácu prehodnotiť a skúsiť to znova.
Časť 2 z 2: Konfigurácia elektrónov vzácneho plynu
 Určte konfiguráciu elektrónov vzácneho plynu. Konfigurácia elektrónov vzácneho plynu je druh skratkového spôsobu zápisu úplnej elektrónovej konfigurácie prvku. Stenografia vzácneho plynu sa používa na zhrnutie elektrónovej konfigurácie prvku a zároveň poskytuje najrelevantnejšie informácie o valenčných elektrónoch tohto prvku.
Určte konfiguráciu elektrónov vzácneho plynu. Konfigurácia elektrónov vzácneho plynu je druh skratkového spôsobu zápisu úplnej elektrónovej konfigurácie prvku. Stenografia vzácneho plynu sa používa na zhrnutie elektrónovej konfigurácie prvku a zároveň poskytuje najrelevantnejšie informácie o valenčných elektrónoch tohto prvku. - Vzácny plyn je substituovaný tak, aby predstavoval všetky elektróny, ktoré nie sú valenčné elektróny.
- Vzácne plyny sú hélium, neón, argón, kryptón, xenón a radón, ktoré sa nachádzajú v poslednom stĺpci periodickej tabuľky.
 Identifikujte vzácny plyn v období pre váš živel. Perióda prvku je vodorovný riadok, v ktorom je prvok umiestnený. Ak je prvok vo štvrtom riadku periodickej tabuľky, je v štvrtom období. Vzácny plyn, ktorý budete používať, je v tretej tretine. Nasleduje zoznam vzácnych plynov a ich periód:
Identifikujte vzácny plyn v období pre váš živel. Perióda prvku je vodorovný riadok, v ktorom je prvok umiestnený. Ak je prvok vo štvrtom riadku periodickej tabuľky, je v štvrtom období. Vzácny plyn, ktorý budete používať, je v tretej tretine. Nasleduje zoznam vzácnych plynov a ich periód: - 1: Hélium
- 2: Neón
- 3: Argón
- 4: Krypton
- 5: Xenón
- 6: Radón
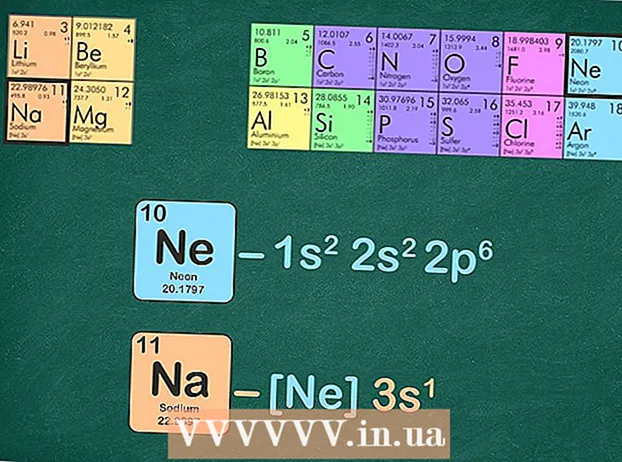
- Napríklad sodík je v období 3. Použijeme neón na konfiguráciu vzácneho plynu, pretože je v období 2.
 Nahraďte vzácny plyn rovnakým počtom elektrónov, aký vzácny plyn má. Existuje niekoľko spôsobov, ako to urobiť v ďalšom kroku. Môžete napísať elektrónovú konfiguráciu vzácneho plynu a potom tú istú konfiguráciu nahradiť v prvku, ktorý vás zaujíma. Alternatívou je odstránenie rovnakého počtu elektrónov, aký má vzácny plyn, z prvku, pre ktorý píšete konfiguráciu.
Nahraďte vzácny plyn rovnakým počtom elektrónov, aký vzácny plyn má. Existuje niekoľko spôsobov, ako to urobiť v ďalšom kroku. Môžete napísať elektrónovú konfiguráciu vzácneho plynu a potom tú istú konfiguráciu nahradiť v prvku, ktorý vás zaujíma. Alternatívou je odstránenie rovnakého počtu elektrónov, aký má vzácny plyn, z prvku, pre ktorý píšete konfiguráciu. - Napríklad sodík má 11 elektrónov a neón 10 elektrónov.
- Konfigurácia úplného elektrónu pre sodík je: 1s22p3s a neón je 1s22p. Ako vidíte, sodík má 3 s, ktoré neón nemá - preto sa konfigurácia vzácneho plynu pre sodík stáva [Ne] 3 s.
- Prípadne môžete počítať horné indexy energetických úrovní, kým nebudete mať desať. Odstráňte tieto energetické úrovne a nehovoriac o tom, čo zostane. Ak na napísanie elektrónovej konfigurácie sodíka použijete neón, zostane vám jeden elektrón: [Ne] 3s.
Varovania
- Iba v neutrálnom atóme sa atómové číslo rovná počtu elektrónov. Ión obsahuje iný počet elektrónov. Ak má ión náboj -1, má jeden elektrón navyše. Náboj -2 má dva ďalšie elektróny atď.



