Autor:
Christy White
Dátum Stvorenia:
8 Smieť 2021
Dátum Aktualizácie:
1 V Júli 2024
Obsah
- Na krok
- Metóda 1 z 3: Prvá časť: Porozumenie elektrónovým granátom
- Metóda 2 z 3: Druhá časť: Nájdenie valenčných elektrónov v kovoch, s výnimkou prechodných kovov
- Metóda 3 z 3: Tretia časť: Nájdenie valenčných elektrónov v prechodných kovoch
- Tipy
- Nevyhnutnosť
Valenčné elektróny ležia vo vonkajšom obale prvku. Počet valenčných elektrónov v atóme určuje typ chemickej väzby, ktorú môže tento prvok vytvárať. Najlepším spôsobom, ako zistiť počet valenčných elektrónov, je použiť periodickú tabuľku prvkov.
Na krok
Metóda 1 z 3: Prvá časť: Porozumenie elektrónovým granátom
 Periodická tabuľka prvkov. Toto je tabuľka s farebnými kódmi, kde sa v každej bunke zobrazuje prvok s atómovým číslom a 1 až 3 písmenami ako symbolom.
Periodická tabuľka prvkov. Toto je tabuľka s farebnými kódmi, kde sa v každej bunke zobrazuje prvok s atómovým číslom a 1 až 3 písmenami ako symbolom.  Nájdite atómové číslo prvku. Atómové číslo je nad alebo vedľa symbolu prvku. Napríklad: Bór (B) má atómové číslo 5, čo znamená, že má 5 protónov a 5 elektrónov.
Nájdite atómové číslo prvku. Atómové číslo je nad alebo vedľa symbolu prvku. Napríklad: Bór (B) má atómové číslo 5, čo znamená, že má 5 protónov a 5 elektrónov.  Nakreslite jednoduché znázornenie atómu a umiestnite elektróny na obežnú dráhu okolo jadra. Tieto práce sa tiež nazývajú škrupiny alebo energetické úrovne. Maximálny počet elektrónov, ktoré môžu byť v rovnakom obale, je pevne stanovený a škrupiny sa plnia od vnútornej k vonkajšej obežnej dráhe.
Nakreslite jednoduché znázornenie atómu a umiestnite elektróny na obežnú dráhu okolo jadra. Tieto práce sa tiež nazývajú škrupiny alebo energetické úrovne. Maximálny počet elektrónov, ktoré môžu byť v rovnakom obale, je pevne stanovený a škrupiny sa plnia od vnútornej k vonkajšej obežnej dráhe. - K Kryt (vnútorný): maximálne 2 elektróny.
- L Kryt: maximálne 8 elektrónov.
- M Shell: maximálne 18 elektrónov.
- N Shell: maximálne 32 elektrónov.
- O obal: maximálne 50 elektrónov.
- P obal (vonkajší): maximálne 72 elektrónov.
 Nájdite počet elektrónov vo vonkajšom obale. Toto sú valenčné elektróny.
Nájdite počet elektrónov vo vonkajšom obale. Toto sú valenčné elektróny. - Keď je valenčný shell plný, prvok je stabilný.
- Ak valenčný obal nie je plný, je prvok reaktívny, čo znamená, že sa môže chemicky naviazať na atóm iného prvku. Každý atóm zdieľa svoje valenčné elektróny v snahe o doplnenie valenčného obalu.
Metóda 2 z 3: Druhá časť: Nájdenie valenčných elektrónov v kovoch, s výnimkou prechodných kovov
 Očíslovajte každý stĺpec periodickej tabuľky od 1 do 18. Vodík (H) je v hornej časti stĺpca 1 a hélium (He) v hornej časti stĺpca 18. Toto sú rôzne skupiny prvkov.
Očíslovajte každý stĺpec periodickej tabuľky od 1 do 18. Vodík (H) je v hornej časti stĺpca 1 a hélium (He) v hornej časti stĺpca 18. Toto sú rôzne skupiny prvkov.  Každému riadku dajte číslo od 1 do 7. Toto sú obdobia prvkov a zodpovedajú počtu škrupín alebo energetickým hladinám atómu.
Každému riadku dajte číslo od 1 do 7. Toto sú obdobia prvkov a zodpovedajú počtu škrupín alebo energetickým hladinám atómu. - Vodík (H) a hélium (He) majú 1 plášť, zatiaľ čo Francium (Fr) ich má 7.
- Lantanoidy a aktinidy sú zoskupené a uvedené pod hlavnou tabuľkou. Všetky lantanoidy patria do obdobia 6, skupiny 3 a všetky aktinidy patria do obdobia 7, skupiny 3.
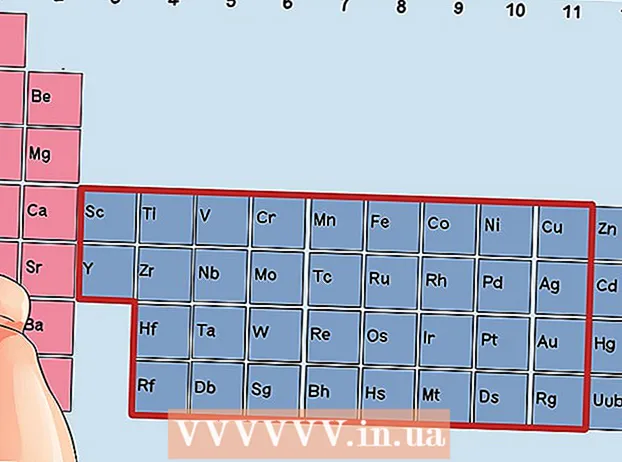
 Vyhľadajte prvok, ktorý nie je prechodným kovom. Prechodné kovy sú v skupinách 3 až 12. Čísla skupín ostatných kovov označujú počet valenčných elektrónov.
Vyhľadajte prvok, ktorý nie je prechodným kovom. Prechodné kovy sú v skupinách 3 až 12. Čísla skupín ostatných kovov označujú počet valenčných elektrónov. - Valenčný elektrón skupiny 1: 1
- Skupina 2: 2 valenčné elektróny
- Skupina 13: 3 valenčné elektróny
- Skupina 14: 4 valenčné elektróny
- Skupina 15: 5 valenčných elektrónov
- Skupina 16: 6 valenčných elektrónov
- Skupina 17: 7 valenčných elektrónov
- Skupina 18: 8 valenčných elektrónov - okrem hélia, ktoré má 2
Metóda 3 z 3: Tretia časť: Nájdenie valenčných elektrónov v prechodných kovoch
 Nájdite prvok zo skupín 3 až 12, prechodné kovy.
Nájdite prvok zo skupín 3 až 12, prechodné kovy. Určte počet valenčných elektrónov na základe počtu skupín. Tieto čísla skupín zodpovedajú možnému počtu valenčných elektrónov.
Určte počet valenčných elektrónov na základe počtu skupín. Tieto čísla skupín zodpovedajú možnému počtu valenčných elektrónov. - Skupina 3: 3 valenčné elektróny
- Skupina 4: 2 až 4 valenčné elektróny
- Skupina 5: 2 až 5 valenčných elektrónov
- Skupina 6: 2 až 6 valenčných elektrónov
- Skupina 7: 2 až 7 valenčných elektrónov
- Skupina 8: 2 alebo 3 valenčné elektróny
- Skupina 9: 2 alebo 3 valenčné elektróny
- Skupina 10: 2 alebo 3 valenčné elektróny
- Skupina 11: 1 alebo 2 valenčné elektróny
- Skupina 12: 2 valenčné elektróny
Tipy
- Prechodné kovy môžu mať valenčné škrupiny, ktoré nie sú úplne plné. Stanovenie presného počtu valenčných elektrónov v prechodných kovoch si vyžaduje určité princípy kvantovej teórie, ktoré presahujú rámec tohto článku.
Nevyhnutnosť
- Periodická tabuľka prvkov
- Ceruzka
- Papier